1899年、P. Ehrlichは、殺菌作用をもつ化学物質は、微生物と親和性を持ち、かつ固有の作用を示す必要があると考えた。つまり、抗生物質は、結合グループ(haptophore)と活性グループ(toxophore)を持つ必要がある。この考えから、生体成分と親和性のある色素に注目した。1935年、G. Domagkが赤色prontosilの殺菌効果を発見し、直後にパスツール研究所のグループが活性本体としてスルホンアミド(サルファ剤、sulfomanide)を見出した。1929年、A. Flemingがペニシリン(penicillin)の記載をして以来、本格的な抗生物質の開発が始まった。細菌性肺炎の死亡率が30%あったものが、サルファ薬により10%になり、ペニシリンにより5%に減少した。
...
耐性機構 | 薬物 | 解説 |
|---|---|---|
不活性化酵素の誘導産生 |
|
|
| β‐ラクタム系(β-lactams) | βーラクタマーゼ(β-lactamase)による分解 |
| クロラムフェニコール(chloramphenicol) | CATase(-OH基をアセチル化)、アセチル化されると細胞膜の透過性が低下する(外膜変化)。 |
| アミノグリコシド系(aminogylcosides) | AAC(-NH2基をアセチル化)、APH(-OH基をリン酸化)、AAD(-OH基をアデニル化) |
細胞膜透過性の変化 |
|
|
| テトラサイクリン(tetracycline) | 細胞膜の透過性の変化により、テトラサイクリン(tetracycline)の流入を抑制する。 |
| ホスホマイシン(fosfomycin) | 能動輸送系の変化(排出ポンプ) |
| ほとんどすべての薬剤 | 緑膿菌は、菌体の周りに粘性に富んだ強力な保護膜(バイオフィルム)を形成することがあ。これにより抗菌薬が菌体に近づけなくなる。MDRP (多剤耐性緑膿菌、multidrug-resistant Pseudomonas aeruginosa) | |
作用点の変化 |
|
|
| マクロライド系(macrolides) | 50Sリボソームの変化 |
| アミノグリコシド系(aminogylcosides) | 30Sリボソームの変化 |
| ニューキノロン系(qinolones) | DNA gyrase の変化 |
| リファンピシン(rifampicin) | RNA polymeraseの変化 |
| サルファ剤(sulfonamides) | DHP synthaseの点変異 |
| メチシリン(methicillin) | 代替酵素の誘導産生(PBP-2') |
...
広域抗菌薬を用いたときに起こりやすい。それまで少数であった生き残り細菌(緑膿菌、耐性菌、真菌など)が増殖すること。良く知られているのは、ディフィシル菌(Clostridium difficile)による偽膜性大腸炎や出血性腸炎である。この菌はヒトの腸管の常在菌であるが、抗菌薬の投与により菌交代症を起こした場合、腸管内で菌が増殖して毒素を産生し、偽膜性大腸炎や出血性腸炎を引き起こすため、病院内感染として問題となっている。
5)抗菌薬の効果に関与するパラメーター(PK-PD理論)
...
分類 | 薬物 | 作用機作 | 副作用 |
|---|---|---|---|
サルファ剤(sulfonamides) | スルファメトキサゾール(sulfamethoxazole) | ジヒドロプテロイン酸合成酵素(dihydropteroate synthase)の阻害により葉酸合成を阻害する。動物では葉酸を食餌から摂取するので、サルファ薬は作用しない。 | 血液障害 。過敏症。酸性尿下での析出による腎および尿路障害。新生児では、アルブミンが少ないので、高ビリルビン血症を引き起こす。皮膚粘膜眼症候群(Stevens-Johnson症候群)。 |
サルファ剤との併用薬(ST合剤) | トリメトプリム(trimethoprim) | ジヒドロ葉酸還元酵素(dihydrofolate reductase)を阻害する。サルファ薬との併用により相乗的に働く。 |
|
...
薬物 | 作用機作 | 副作用 |
|---|---|---|
シプロフロキサシン(ciprofloxacin) | DNA gyrase 阻害によりDNA複製を阻害する。動物細胞でのtopoisomerase II にはほとんど作用しない。胆汁や前立腺にも高濃度で分布し、また尿中に高濃度排泄される。尿路感染症に最も有効である。シプロフロキサシン(CPFX )はグラム陰性桿菌と緑膿菌感染に使用される。レボフロキサシン(LVFX )は経口薬で唯一抗緑膿菌活性を持つ薬物である。シタフロキサシン(sitafloxacin、STFX)は呼吸器および尿路感染症に有効で、他のキノロン系薬の耐性菌にも働く。 | 胃腸障害、過敏症、精神神経症状など。薬物相互作用(QT延長を来す薬剤との併用、 経口血糖降下薬との併用、MgやFe剤やアルミニウム製剤との併用における吸収低下(キレート形成)、 NSAIDsとの併用(痙攣誘発のリスク))に注意が必要である。結核菌に効果があり、肺結核の診断を遅らせる可能性がある。 |
レスピラトリーキノロン:呼吸器組織(上気道も含む)への移行が良好で,ほとんどすべての呼吸器感染症起炎菌に対する抗菌力を有する,特に肺炎球菌への抗菌活性が強化されたニューキノロン系抗菌薬のこと。モキシフロキサシン(MFLX)は抗菌力や薬物動態において上記の薬物では最も優れている。特に、腎機能障害患者ではMFLXを選択すべきである。緑膿菌や嫌気性菌までを想定する場合はシタフロキサシン(STFX)を、高齢者など安全性を重視する際にはレボフロキサシン(LVFX)を選択することが推奨される。
...
PBP-1A, PBP-1B | transpeptidase |
PBP-2 | methicillinに親和性あり。 |
PBP-2' | MRSAで誘導産生される。 |
PBP-3 | 隔壁形成 |
PBP-4 | carboxypeptidase |
4)β-ラクタマーゼ阻害剤配合剤
タゾバクタム(tazobactam)、スルバクタム(sulbactam)やクラブラン酸(clavulanic acid)などのβーラクタマーゼ(β-lactamase)阻害薬は、それ自身の抗菌作用は低いが、βラクタマーゼと不可逆的に結合し、その酵素活性を半永久的に不活化することで、β−ラクタム系抗菌薬の治療効果を高める。
タゾバクタム(tazobactam):ピペラシリン(piperacillin)=1:8の製剤は、誤嚥性肺炎や院内肺炎などの重症感染症に用いられている。MRSAと非結核性抗酸菌症(非定型抗酸菌症)には効かない。
スルタミシリン(sultamicillin)は、経口投与後速やかに吸収され、腸管のエステラーゼにより加水分解されてアンピシリン(ampicillin)とスルバクタム(sulbactam)とになり、それぞれ高い血中濃度を示す。アンピシリンとスルバクタムの合剤。βラクタマーゼ産生性耐性菌に有効。単独投与時より高い血中濃度が得られる。誤嚥性肺炎や院内肺炎などの重症感染症に用いられている。
...
分類 | 薬物 | 特徴 |
|---|---|---|
第一世代 | セファロリジン(cephaloridine) | penicillinaseに安定、cephalosporinaseに不安定。黄色ブドウ球菌(MSSA)、連鎖球菌などのグラム陽性菌に効くが、肺炎球菌,腸球菌,リステリアには効かない。グラム陰性菌には使われない。セファロリジンとセファゾリンは静注で用いられる。セファレキシンは経口で用いられ、バイオアベイラビリティは高い。髄液には移行しない→髄膜炎には使えない。 |
第二世代 | セフォチアム(cefotiam) | cephalosporinaseに安定、グラム陰性菌に対する抗菌力が増強され、インフルエンザ菌、大腸菌などの陰性桿菌にも有効。静注あるいは筋注で用いられる。髄液には移行しない。 |
第三世代 | セフォタキシム(cefotaxime) | 高い安定性、抗菌力増強、緑膿菌やセラチアにも有効。逆にグラム陽性菌への抗菌力が弱くなる。肺炎+尿路感染をほぼカバーできる。髄液にも移行する。セフトリアキソンは、ほとんどの口内嫌気性菌をカバーするので、口腔衛生が保たれていれば、市中誤嚥性肺炎への使用が推奨される。 腸内細菌叢の急激な抑制に伴うビタミンKの欠乏により出血をおこすことがある。 この世代の経口剤は、バイオアベイラビリティが16~46%と低い。一方、腸での吸収改善のためにピボキシル化された薬物では、小児(特に乳幼児)において血中カルニチンの低下に伴う低血糖症状(意識レベル低下、痙攣等)がおこることがある(サイトへ)。 |
第四世代 | セフピロム(cefpirome) | 第一世代のグラム陽性菌への抗菌力と第三世代のグラム陰性菌への抗菌力を持ち、黄色ブドウ球菌や緑膿菌にも有効。髄液移行性もある。MRSA、腸球菌、嫌気性菌には効かない。 |
...
セファマイシン系は基本骨格にメトキシ基を持つことによりβーラクタマーゼ(β-lactamase)に対して極めて安定である。大腸菌,プロテウス,クレブシエラなどに有効。嫌気性菌にもほぼ有効。セフブペラゾン(cefbuperazon)、セフメタゾール(cefmetazole)などがある。
c) カルバペネム系(carbapenems)
グラム陽性菌、緑膿菌などのグラム陰性菌、嫌気性菌になどに対して超広範囲スペクトルを持ち、ペニシリナーゼやセファロスポリナーゼにも安定である。近年、カルバペネマーゼを産生する耐性菌が出現しているので、長期間の使用による多剤耐性緑膿菌の出現に注意すべきである。天然型のイミペネム(imipenem)は腎尿細管のデヒドロペプチダーゼ-I(DHP-I) に分解され、腎毒性を示すので、イミペネムとDHP-I阻害薬のシラスタチン(cilastatin)との配合薬として用いる。メロペネム(meropenem)、ビアペネム(biapenem)はDHP-Iに安定で腎毒性や神経毒性を示さず、単独で用いることができる。経口剤としてテビペネムピボキシル(tebipenem-pivoxil)がある。カルバペネム系薬物は個々のスペクトルは大差がなく、使い分ける必要はないとされる。MRSAや腸球菌には効果がないが超広範囲スペクトルのために耐性菌が生じやすいとされている。実際、カルバペネム系の使用が多い病院では耐性菌の発生も多いという報告もあるので、最後の切り札としてとって置くといういう意見もある(サイトをみる)。
d)モノバクタム系(monobactams)
他のβ-ラクタム系抗生物質はラクタム環に別の環が結合しているのに対して、本化合物はラクタム環が単独で存在している。 β-lactamaseに対して安定。グラム陰性菌にのみ抗菌作用を発揮し、その効力は第三世代セフェム系よりも強い。そのために菌交代現象(偽膜性腸炎など)を起こしにくいとされる。アズトレオナム(aztreonam)、カルモナム(carumonam)などがある。
e) ホスホマイシン(fosfomycin)
...
バンコマイシン(vancomycin)が代表的な薬物である。βラクタム剤とは作用機序が異なり、細胞壁合成酵素には結合せず、細胞壁を構成するペプチドグルカン前駆体に強く結合して細胞壁の合成を阻害し、細胞壁の合成を阻害する。高分子(MW1500)であるため、グラム陰性菌を通過できない。従ってグラム陽性菌にのみ有効である。MRSAに対する第一選択薬である。別の抗生物質で引き起こされる「偽膜性大腸炎」にも有効。偽膜性大腸炎は、抗生物質により腸内の善玉細菌が死滅し、生き残ったクロストリジウム・ディフィシルという細菌が異常に増殖することで発症する。vancomycinは、そのクロストリジウム・ディフィシルに対し強い抗菌力を発揮する。
...
| Html macro | ||||
|---|---|---|---|---|
| ||||
<script type='text/javascript' src='https://chemapps.stolaf.edu/jmol/jmol.php?model=chloramphenicol&link=3D modelはここをクリック&caption=chloramphenicol&script=background white;rotate x 180'></script> |
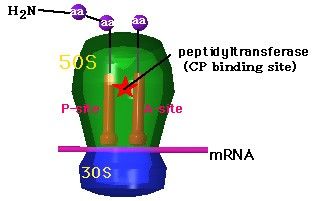
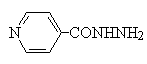
chloramphenicol は、リボソーム(50S)上でのP座のペプチジルtRNAから、A座のアミノアシルtRNAへのペプチド鎖移動を司るペプチジルトランスフェラーゼ(peptidyltransferase9 に結合し、新しいアミノ酸を利用できないようにすることで蛋白質合成を阻害する。 |
...
結核菌は活動性結核患者が咳やくしゃみをした時に飛び散り、それを周りの人が直接吸い込むことによって感染する。結核の初期症状は、風邪とよく似ている。ツベルクリン反応、インターフェロン-γ遊離試験、喀痰の塗抹培養、PCRなどによる早期発見が適切な治療につながり、また集団感染などの事例をなくすことにもつながる。(公益財団法人結核予防会のHPより改変して転載)
...
2)イソニアジド(isoniazid、INH、イソニコチン酸ヒドラジド)
結核菌に特有のミコール酸の合成阻害。休止菌には作用しない。殺菌的作用。
副作用として、末梢神経炎がある。ピリドキシン(pyridoxine、vitamine B6)と拮抗するためにおこる。神経障害を予防するために、ピリドキシンがイソニアジドと共に投与されることがある。
3)エタンブトール(ethambutol、EB)
ミコール酸の合成と結核菌細胞壁へのミコール酸の取り込みを阻害する。結核菌に対し特異的に作用し、他の抗結核薬と交叉耐性を示さない。イソニアジドまたはストレプトマイシンと併用することにより耐性菌の出現は低減され、それらの耐性菌にも有効。副作用として、視神経障害と重篤な肝障害がある。
4)ピラジナミド(pyrazinamide、PZA)
主に静菌的に作用するが、活発に分裂する結核菌に対しては殺菌的に作用する。 治療初期に有効であり、リファンピシン、イソニアジドとの併用により再発率が低下するとされている。治療初期 2 カ月間に PZA を加えた初期強化療法は,薬剤耐性発現の防止,早期の菌陰性化,治療期間の短縮化など,患者に多くの利益がもたらされるとされる。1996 年に結核医療の基準が改定され,標準化学療法の一つとなり、その使用が勧められている。PZA を含む 4 剤併用療法が広く普及し、PZA含む治療方式が標準化学療法の一つとなった。
c)結核の標準治療
薬剤感受性が確認できない初期治療では、イソニアジド(INH)とリファンピシン(RFP)に、エタンブトール(EB)またはストレプトマイシン(SM)を加えた3剤以上の併用が必要。さらにピラジナミド(PZA)を加えた4剤処方により、薬剤耐性発現の危険性低下、治療期間の短縮が期待できる。ただし、肝障害患者および妊婦では使用を避け、80歳以上の高齢者への使用は慎重に。標準治療薬には、リファブチン(RBT)もあるが、使用可能な薬剤数が不足する場合に十分に検討したうえで使用(メディカルオンラインより)。わが国の結核患者は高齢者が多いこと、また高齢者は死亡者が多いことなどから、PZA が使用されるようになっても治療成績は悪く、WHO の目標とする治療成功率 85% に達していない。
6、代表的な耐性菌とその治療薬
抗菌薬(抗生物質)の不適切な使用が薬剤耐性(Antimicrobial Resistant: AMR)の問題を生んでいる。ヒトは多くの微生物と共存しているが、抗菌薬を使用することで、これらの常在菌から耐性菌が選ばれ、将来薬剤耐性菌による感染症を発症する危険性が生じる。抗菌薬は細菌感染には効果があるが、ウイルスには効果がない。しかし、ウイルスの上気道感染である風邪症候群に抗生物質が効くと信じている患者はいまだ多い。医師も、ウイルス感染症と診断しても、細菌による二次感染するのを予防する目的で、抗菌薬を処方することが少なくない。しかし、このような二次感染を予防するエビデンスはなく、体内で耐性菌を増やす原因を作るだけである。また、抗菌薬を使用する時は、原因菌を同定し、菌に有効だとされる抗菌スペクトルの狭い薬物を使うのが原則であるが、原因菌を同定せずに第三世代セファム系などの薬物が使われることも耐性菌を生じる原因である。現状のような抗菌薬の乱用が続けば、抗菌薬の開発が耐性菌の出現に追いつかないため、2050年には世界での耐性菌感染症による死亡者ががんによる死亡者を超して1000万人にも達するという試算も出ている。
1)グラム陽性球菌
| 耐性菌 | 説明 | 治療薬 |
|---|---|---|
| MRSA(メチシリン耐性黄色ブドウ球菌、Methicillin-Resistant Staphylococcus aureus) | β-ラクタム剤が結合できないペプチドグリカン合成酵素(PBP2')を作ることでβ-ラクタム剤の作用を回避する。PBP2’の遺伝子mecAを含む遺伝子領域が、他の菌種から黄色ブドウ球菌に持ち込まれ、染色体上に挿入されたことによる。 多剤耐性:ほとんどのMRSAが、ペニシリンだけでなく、セフェム系、カルバペネム系、ニューキノロン系、アミノグリコシド系薬剤など多剤に耐性となっている。 | バンコマイシン(vancomycin 、VCM, グリコペプチド系、第一選択薬、要TDM)、ダプトマイシン(daptomycin、DAP、環状リポペプチド系、呼吸器感染には使えない)、テイコプラニン(teicoplanin 、TEIC, ペプチド系、要TDM)、リネゾリド(linezolid 、LZD, オキサゾリジノン系、タンパク質合成阻害、VRE・VRSAの治療薬 → MRSAにも使用拡大、内服薬あり(吸収率99%))、アルベカシン(arbekacin、ABK, アミノグリコシド系、副作用:腎障害、聴力障害、組織移行不良) |
| VRE(バンコマイシン耐性腸球菌、Vancomycin Resistant Enterococci) | ほとんどの薬剤に耐性であり、感染症が起きた場合には治療が困難。ハイリスク患者には伝播が起こりやすいため注意が必要。 | リネゾリド(linezolid 、LZD, オキサゾリジノン系、タンパク質合成阻害)他に安定した効果が期待できる抗菌薬はない。既にリネゾリドに耐性化した菌も報告されている。感染予防が極めて重要。 |
2)グラム陰性桿菌
| 耐性菌 | 説明 | 治療薬 |
|---|---|---|
| ESBL(extended-spectrum β-lactamase)産生菌 | ESBLとは基質特異性拡張型βラクタマーゼ(extended-spectrum β-lactamase)の略称。Klebsiella pneumoniae や Escherichia coli などが保有する伝達性プラスミド上にコードされているβラクタマーゼ産生遺伝子が、突然変異により分解可能な薬剤の種類を広げ、ペニシリンだけではなく、第三世代の広域セフェム系まで分解するβラクタマーゼを産生するようになったもの。このESBLは、クラブラン酸などのβラクタマーゼ阻害薬によりその活性が阻害される。 | カルバペネム系抗菌薬(イミペネム(imipenem)、メロペネム(meropenem)、ビアペネム(biapenem))の有効性は確立されている。重症感染症に対してはカルバペネム系抗菌薬が第一選択薬となる。軽度~中等度の尿路感染症や胆道感染症には、β-ラクタマーゼ阻害剤配合薬、セファマイシン系等が使用される場合がある。 |
| MDRP (多剤耐性緑膿菌、multidrug-resistant Pseudomonas aeruginosa) | カルバペネム系、ニューキノロン系、アミノグリコシド系の3系統に耐性をもったものを多剤耐性緑膿菌(MDRP)と呼ぶ。耐性メカニズムは、① DNA ジャイレースなどの標的蛋白の変異(フルオロキノロン耐性)、② D2 ポリンの減少など細菌外膜の変化(イミペネム耐性)、③ 薬剤能動排出ポンプの機能亢進(フルオロキノロン耐性、消毒薬抵抗性など)、④ AmpC 型β‐ラクタマーゼなど分解酵素の過剰産生(広域セファロスポリン耐性)、⑤ バイオフィルムの産生の増加など、複数あるが、プラスミド性の耐性遺伝子伝播も重要な役割。→接触感染予防が重要となる。 | 現存するすべての抗緑膿菌抗菌薬に対して耐性を持つ。治療としては、①コリスチン(日本未認可薬剤)あるいは、②併用抗菌薬療法?・・・単剤では治療困難な抗緑膿菌作用のある薬剤を2剤併用する。ぐらいしかない。感染予防が極めて重要。多剤耐性緑膿菌感染症についての感染症情報センターの医療者向け情報はこちら。 |
...
1、東京医科大学病院感染制御部による「プライマリーケアのためのワンポイントレクチャー 感染症① 感染症② 感染症③ 多剤耐性菌の耐性機序と治療薬
2、国立感染症研究所 感染情報センター 薬剤耐性菌感染症
3、抗菌薬インターネットブック
4、薬剤耐性について知っていますか?
(久野)