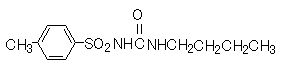糖尿病治療薬(Drugs for Diabetes Mellitus)
1、糖尿病(Diabetes mellitus)
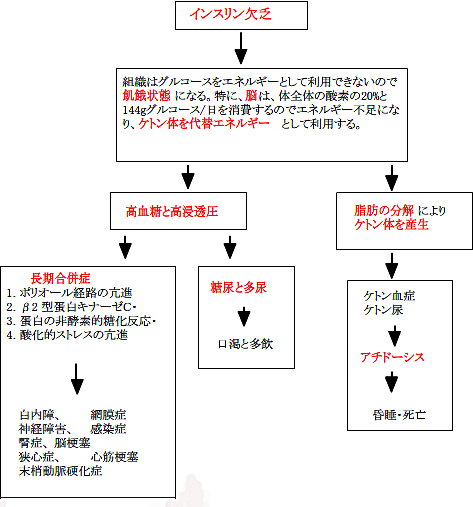
糖尿病は、インスリンの欠乏により、慢性的に高血糖を来す疾患であり、種々の特有の代謝異常を伴う疾患群である。40才以上では10人に1人が糖尿病である。2009年6月に、米国(ADA)、国際(IDF)と欧州(EASD)の3団体が、新しい糖尿病診断基準を「HbA1c 6.5%(NGSP値)以上を糖尿病とする」と定めた。HbA1c 6.5%(NGSP値)は 6.1%(JDS値)に相当。
糖尿病の診断は、A)と B)を合わせて行う。
A)以下の4項目のいずれかがあれば糖尿病型とする。
1) 空腹時血糖値が 126 mg/dL 以上の場合
2) 非空腹時血糖値が 200 mg/dL 以上の場合
3) 経口ブドウ糖負荷試験 (OGTT) 2時間値が 200 mg/dL 以上の場合
4) HbA1cが6.5%(NGSP値)以上の場合
B)上記の糖尿病型に下記の項目のいずれかが加われば糖尿病とする。
1)違う検査日で糖尿病型が2回確認された場合
2)糖尿病の特徴的な症状(口渇、多飲・多尿、体重減少など)がある場合
3)過去に糖尿病と診断された病歴がある場合
4)糖尿病性網膜症がある場合
糖尿病は、成因により4つの型に分類される。
1型糖尿病(Type 1) | 膵β細胞破壊に基づく糖尿病で、自己免疫が発症に関与。抗グルタミン酸脱炭酸酵素(Glutamic Acid Decarboxylase:GAD)抗体は、自己免疫性1型糖尿病の診断に必須の膵島関連自己抗体である。生命維持のためにインスリン注射が不可欠である。糖尿病全体の約5%が1型糖尿病と考えられている。1型糖尿病の発症は小児~思春期に多いと考えられていたが、実際には30歳以降の発症も多く、全体の半数に上る。 |
|---|---|
2型糖尿病(Type 2) | 膵β細胞からのインスリン分泌低下と、肝臓、筋肉や脂肪組織におけるインスリン抵抗性による。加齢変化や遺伝素因(体質)に環境要因(生活習慣)が重なることによって発症する。過食による肥満や運動不足などの生活習慣の乱れによってインスリン抵抗性が増大し、相対的にインスリン作用が低下することによって高血糖状態が持続すると、インスリン抵抗性を助長し、これがインスリン分泌を低下させるという悪循環になる。 |
その他の特定機序、疾患に | 遺伝子異常が解明されたもの。他の疾患や状態に伴うもの。 |
妊娠糖尿病 | 妊娠中に発病、あるいは発見された耐糖異常 |
2、インスリンの生理作用と分泌機序
1889年、von Mering and Minkowskyが、膵臓を摘出した犬が、糖尿病になることを見出した。
1922年、Banting and Bestが膵外分泌管を結紮し、外分泌腺を破壊して、インスリンを抽出した。
Glucoseは、12回膜貫通型のglucose transporterにより、細胞内に取り込まれる。
タイプ | 組織分布 | 性質 |
|---|---|---|
GLUT4 | 筋肉、脂肪 | インスリン依存性取り込み。血糖下げるのに最も重要な働きをしている。 |
GLUT1 | 脳 | インスリン非依存性取り込み。BBBでの糖の輸送。 |
GLUT2 | 膵臓 | 膵β細胞でのインスリン遊離の調節。 |
| GLUT3 | 小腸、骨格筋 | グルコースセンサーとして働いている。 |
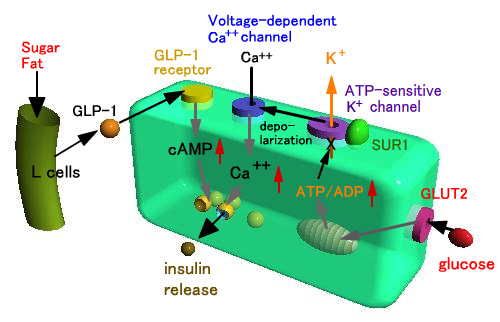
グルコースによる膵β細胞からのインスリン分泌とsulfonylurea類の作用点 |
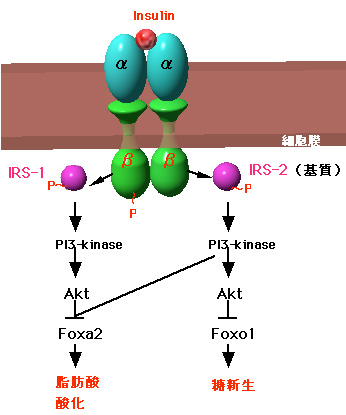
Insulin(左)とその受容体(右) |
3、糖尿病治療薬
日本糖尿病学会(2013年)は、HbA1c(NGSP) の6.0%未満を「血糖正常化を目指す目標」とし、7.0%未満を「合併症予防のための目標」とし、8.0%未満を「治療強化が困難な際の目標」と設定した。
1) インスリン製剤(Insulin preparations)
1型糖尿病および、血糖値が制御しにくい2型糖尿病では、超速攻型インスリンで食事による追加分泌を、持効型インスリンで基礎分泌をカバーすれば、完全なコントロールに近いものが得られる。また、最近では血糖をモニターしてインスリンを自動的に放出するインスリンポンプもできており、普及しつつある(CGM:continuous glucose monitoring、FGM:Flash glucose monitoringなど)。インスリン強化療法で血糖コントロールすることにより、網膜症などの細小血管合併症の発症や進展を阻止できる。
分類 | 製剤 | 内容など | 作用時間 | 作用開始時間 |
|---|---|---|---|---|
超速効型 | insulin lispro | ヒトインスリンB鎖C末のアミノ酸2ヶを置換し、6量体から単体に解離しやすくしたもの。 | 5hr | 15-30min |
速効型 | regular insulin | ヒトインスリン製剤は安定した6量体を形成しており、皮下注射後に組織液で希釈されて2量体、単量体となって血中に移行、効果を発現する。したがって、生理的インスリンに比べて、投与後の効果発現までに時間がかかり、持続時間は長い。 | 6-18hr | 1hr |
中間型(Intermediate acting) | isophene insulin(NPH) | insulin + protamine + zinc | 18-24hr | 2hr |
持効型(Long acting) | insulin glargine | insulin glargineは、遺伝子組換insulinで皮下で結晶化し、ゆっくり溶け、作用は24時間持続する。insulin detemirはB鎖に脂肪酸を付加したものである。経口薬剤の多剤併用でも目標の血糖コントロールが得られない場合、内服薬を継続しながら時効型インスリンを追加して基礎インスリンを補充する方法(Basal supported oral therapy, BOT)に用いられる。 | 36hr | 7hr |
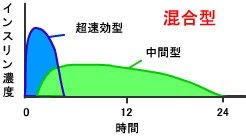
| 混合型 | ヒト二相性イソフェン インスリン水性懸濁液 | 混合型は、基礎分泌と追加分泌を同一製剤で補うことができるよう、中間型インスリンと速効型、あるいは超速効型インスリンを混合した製剤。また、超速効型は、追加分泌の補充という点で、速効型混合製剤よりも生理的なパターンを再現しやすく使用頻度が多くなっている。 | 18-24hr | 10-30min |
副作用
低血糖
血糖の低下が速いときは、epinephrineが遊離されるので、その症状が出る: 発汗、脱力感、空腹感、頻脈など。血糖の低下がゆっくりのときは、脳の症状がでる: 頭痛、視力障害、錯乱、昏睡、痙攣など。注射の局所の皮下脂肪萎縮や全身のアレルギー反応がみられる。
2)経口抗糖尿病薬(oral antidiabetic drugs)
経口抗糖尿病薬は、2型糖尿病で、運動および食事療法で効果が不十分な時に用いる。
種類 | 薬物 | 作用機序や副作用 |
|---|---|---|
スルホニル尿素(Sulfonylureas) | 第1世代: | 膵β細胞を刺激し、insulin分泌を促進し、血糖値を下げる。図のように、ATP-sensitive K+ channelのSUR1 に結合し、Kチャネルを阻害し、結果として細胞の脱分極から、電位依存性Ca++ channelを開き、細胞内Ca++を増加させ、insulin分泌を引き起こす。glibenclamideは最も強力なSU剤。12~24時間持続的に効くので、夜間低血糖がおこる。最も低血糖をおこし易いグループ。また、β細胞の保護効果はなく、むしろ連用により疲弊させるといわれている。食欲が亢進し肥満しやすい。副作用は、低血糖、血液障害、肝障害、アレルギー反応などである。 |
ビグアナイド(Biguanides) | メトホルミン(metformin) | 腎障害などの例外を除き、2型糖尿病の第一選択薬である。嫌気性解糖系を促進させ、glucoseを乳酸に分解し、肝臓からの糖放出を抑制する。ミトコンドリアの呼吸鎖 Complex Ⅰを阻害する。肥満型患者には最も推奨される薬物。夜間低血糖や肥満をおこさない。大腸がんの発生を抑制するともいわれている。稀であるが、重篤な副作用として乳酸アシドーシスがある。ヨード造影剤の投与により一過性に腎機能が低下した場合、ビグアナイド系糖尿病薬の腎排泄が減少し、乳酸の血中濃度が上昇することで、乳酸アシドーシスを起こす危険性があるとされている。高齢者や腎機能の悪い患者では投与に注意する。長期投与は、ビタミンB12欠乏症のリスクを高める。 |
α-グルコシダーゼ阻害剤(α-glucosidase inhibitors、α-GI) | アカルボース(acarbose) | 消化管上皮で、デンプン、マルトースなどをα-glucosidaseで分解し単糖にして、吸収する。この酵素を阻害することにより、糖の吸収を遅らせる。軽症の2型糖尿病に用いる。糖が吸収されずに大腸まで行くので、ガスがたまりやすい。肉食が主な場合は効きにくい副作用は、消化器症状、アレルギー反応がある。劇症肝炎にも注意が必要。 |
チアゾリジン系糖尿病薬(Thiazolidinediones) | ピオグリタゾン(pioglitazone) | インスリン抵抗性改善薬と呼ばれ、peroxisome proliferator-activated receptorγ(PPARγ)と特異的に結合する。脂肪細胞の分化を促進したり、GLUT4やlipoprotein lipaseなどの発現を増大させたり、TNF-α産生を減少させることにより、インスリン抵抗性を改善する。副作用として、肝障害、浮腫、体重増加がある。膀胱癌のリスクが高まる。 |
フェニルアラニン(Phenylalanine)誘導体 | ナテグリニド(nateglinide) | 速効型インスリン分泌促進薬で、インスリン分泌パターン改善薬とも呼ばれる。作用点はSulfonylureasと同じである。夜間低血糖などはおこしにくいが、1日に3回服用する必要があり、患者のコンプライアンスが悪い場合には使いにくい。2型糖尿病の食後血糖の改善に用いる。 |
| インクレチン(Incretin) 関連薬 | DPP-4阻害薬 シタグリプチン(sitagliptin) | incretinは腸管から分泌され、膵臓に作用してinsulinの分泌を促進する。dipeptidyl peptidase 4 (DPP-4)によりincretinは急速に分解される。この酵素を阻害することにより、insulinの作用を強める。低血糖を起こしにくく、食事の影響も受けないので、1日1回いつでも服用ができる利点がある。低血糖のリスクが少ないので高齢者に使いやすく、肥満もおこさない。SU剤との併用では低血糖がおこるので注意。linagliptinは胆汁排泄型。trelagliptinは週1回の投与で有効(半減期38-54hr、作用持続168hr)。 |
GLP-1受容体作動薬 リラグルチド(liraglutide) | インスリン産生を刺激するホルモンであるグルカゴン様ペプチド-1(GLP-1)の半減期は数分である。DPP-4で分解されないGLP-1受容体作動薬である。β細胞上のGLP-1受容体に結合し、食事による血糖値の上昇に応じてインスリンの分泌を促すと同時に、血糖値を上昇させるグルカゴンの分泌を抑制する。皮下注射をする。重大な低血糖はみられない。中枢に働き、体重減少作用がある。リラグルチドと時効型インスリンの配合注射液が2019年9月に承認された。米国では2019年10月、経口GLP-1受容体作動薬(経口セマグルチド、semaglutide)が承認された。 | |
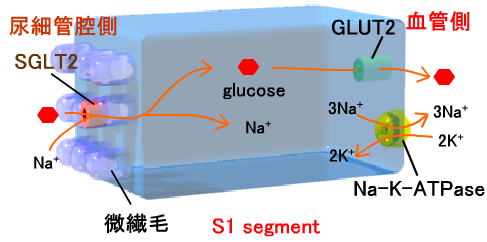
| SGLT2阻害薬 | イプラグリフロジン(ipragliflozin) | SGLT2阻害薬は、SGLT2(Sodium glucose co-transporter 2)を選択的に阻害することにより、近位尿細管でのブドウ糖の再取り込みを抑制し、糖の尿中への排泄を促進することにより、血糖値を低下させる(図)。1日1回の投与で、優れたHbA1c低下作用を示す。主な副作用は、頻尿、脱水、低血糖、尿路感染症、全身性皮疹、体重減少など。 ダパグリフロジンは、慢性腎臓病患者において、2型糖尿病合併の有無に関わらず、腎不全への移行抑制、心血管イベントおよび全死亡に対するの有効性が示され、日本でも保険適用が承認された。 |
tolbutamide
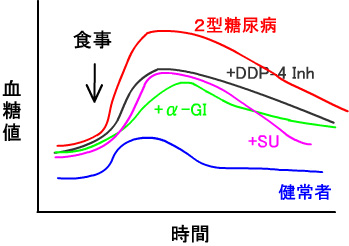
| 2型糖尿病に、経口糖尿病治療薬を投与したときの血糖値下降のモデル曲線 |
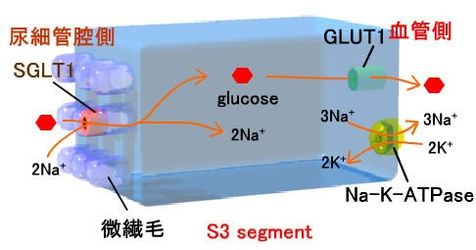
| SGLTは、14回膜貫通型のトランスポーターで、Na+-K+-ATPaseにより形成されるNa+勾配を利用してNa+とglucoseを細胞内に取り込む。 SGLT2は、glucoseとの親和性は低いが、輸送能は高く、Na+/glucoseは1:1で輸送される。糖尿病で発現が増加する。腎臓の近位尿細管のS1 segmentに高発現しており、濾過されたglucoseの90%以上がSGLT2で再吸収される。SGLT2特異的阻害薬は糖の再吸収を阻害することにより、血糖値を下げる。 GLUT2は、glucoseに対してhigh-capacityでlow affinityであり、近位尿細管のS1、S2に発現している。 | |
| SGLT1は、小腸に多く、腎臓の近位尿細管のS3 segmentにも発現している。Na+/glucoseは2:1で輸送される。 glucoseに対して高親和性があるが、その輸送能は低い。galactoseの輸送能もglucoseと同程度である。濾過されたglucoseの10%がSGLT1により再吸収される。 GLUT1は、glucoseに対してlow-capacityでhigh affinityであり、近位尿細管のS3に発現している。 |
話題
英国で、40-75才の2型糖尿病の患者約1,400人にスタチン系薬物(アトルバスタチン(atorvastatin))を3.9年間投与し、プラセボ群(約1,400人)と心血管イベントの発生率を調べたところ、37%の低下がみられた。冠血管系疾患は31-36%減少、脳卒中は48%減少、死亡率も27%減少した。2型糖尿病におけるスタチン療法の有効性が報告された。(H.M.Colhoun et al, Lancet, 365, 685, 2004、論文をみる)
コペンハーゲン大のグループは、肥満(BMI30-40)のある564人に20週にわたり、Liraglutideの1.2、1.8、2.4、3.0mgを1日1回皮下注射し、PlaceboとOrlistat(肥満治療薬)と比較した。全員に低脂肪食と運動療法も併用した。Liraglutideの濃度に比例して、6-8Kgの体重減少を認めた。Orlistaは、4Kgの減少があった。Placeboは3.5Kgの減少であった。Liraglutideは、血圧の低下(5-8mmHG)と前糖尿病の割合も90%近く減少した。副作用は悪心嘔吐であったが、一時的であった。(Astrup.A. et al, Lancet, 374, 1606, 2009、論文をみる)
米国Johns Hopkins大グループによる2型糖尿病治療薬のメタ解析の結果が発表された。166件の研究論文を解析して治療薬(metformin(Metf), 第二世代sulfonylureas(SU), thiazolidinediones(Thia), meglitinides, DPP-4阻害薬, GLP-1受容体作動薬)の効果と副作用を解析した。単独と2薬併用のどれもが、HbA1cを1%減少させた。Metfは、他の薬剤に比べて、体重減少(-2.5Kg)とLDLコレステロールの低下効果が大きかった。SUは、Metfよりも低血糖リスクが4倍高かった。Thiaは、SUに比べて心不全のリスクが高く、Metfに比べて骨折のリスクが高かった。MetfはThiaに比べて下痢の頻度が高かった。結論として、Metfが2型糖尿病の治療薬の第一選択薬として支持されること、2薬併用は低血糖などの副作用リスクを増加させることが分かった。(W.L.Bennett et al, Ann Int Med, 154, 602, 2011、論文をみる)
日本人を対象とした糖質制限食とカロリー制限食の効果を比較したランダム化比較試験(RCT)の報告。対象は、カロリー制限食指導後も血糖コントロール不良の2型糖尿病患者。6カ月間の糖質制限食(130g/day)指導を行い、その後12カ月間自己管理するグループと、6カ月間のカロリー制限食の後12カ月間自己管理したグループの血糖(HbA1C)と体重を調べて比較した。その結果、6カ月の短期間では糖質制限の方がカロリー制限よりも有意に体重を減らした。しかし、長期的には優位差はなくなり、どちらの食事療法も血糖と体重管理に同程度に有効であることが示唆された。2型糖尿病をり患していない中高年が行う美容的(?)ダイエットの場合は、腎臓などへの負担を考えると、カロリー制限が無難かもしれない。(J. Sato et al, PLoS One. 2017; 12(12): e0188892、論文をみる)
関連サイトの紹介
1、国立国際医療研究センター 糖尿病情報センター 血糖値を下げる飲み薬 血糖値を下げる注射薬
2、糖尿病ネットワーク 「糖尿病の飲み薬」を知って効果的に治療
(三木、久野)