パーキンソン病治療薬(Anti-Parkinsonian Drugs)
1、パーキンソン病(Parkinson disease)について
比較的頻度の高い錐体外路系の変性疾患で、中脳の腹側被蓋野 ventral tegmental area (VTA)のドパミン作動性ニューロンの変性がある。 その結果、相対的にコリン作動性ニューロンの活動の上昇が見られる。日本では120人/10万人、65歳以上では200人/10万人(全国では15万人) 。30~80才に発病し、中年以降に多く、ゆっくり進行する。40歳以下で発症した場合を若年性パーキンソン病と呼ぶ。
3主症状:静止時振戦(resting tremor)、筋強直(rigidity)、無動・寡動(bradykinesia、slow movement)。その他、姿勢反射障害(postural instability、バランスがとりづらくなる)、 非運動症状(自律神経症状、精神症状)などがある。
2018年のパーキンソン病診療ガイドラインでは、1)運動緩慢を必須条件とし、2)静止時振戦か筋強剛の一方あるいは両方見られるもをパーキンソン病の定義としている。また、嗅覚障害も90%に認められ、パーキンソン病認知症になるリスクが高い。なお、姿勢反射障害は進行期になって出現するので定義から外された。
大部分の原因は不明であるが、二次的には、ウイルス、外傷、中毒、血管障害、薬物の副作用などでも起こる。黒質を中心とした変性では、レビー小体(Lewy body)とよばれる特徴的な細胞質内封入体が認められる。レビー小体の主成分の1つがα-シヌクレイン(α-synuclein)で、この異常な凝集が原因とする説が有力である。遺伝性のものとして、常染色体劣性遺伝性若年性パーキンソン病 (autosomal-recessive juvenile parkinsonism, AR-JP)と家族性の優性遺伝型パーキンソン病が解析されている。前者は、比較的症状が軽度で、黒質DAの変性は見られるが、レビー小体はない。この原因遺伝子(parkin)は第6染色体上にあり、ユビキチンリガーゼ(ubiquitin ligase)活性を持つ。後者の原因遺伝子は、4番染色体上のα-シヌクレイン(α-synuclein)遺伝子で、それに変異があると報告されている。
2、パーキンソン病のにおける各種ニューロンの相互作用
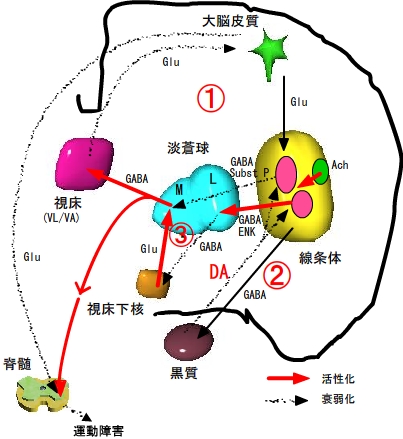
運動制御の主経路は、1)大脳皮質->線条体->淡蒼球->視床->皮質である。副経路は、2)黒質<->線条体(運動の促進作用)と、3)淡蒼球↔視床下核(運動の制止作用)である。 |
3、MPTP中毒説について
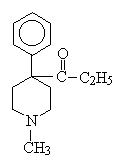
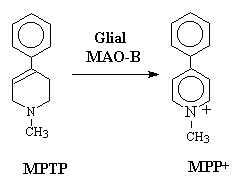
アメリカで、自分で合成した合成ヘロイン(pethidine)を注射した学生がパーキンソン病になった。合成ヘロインのby-productである methy-phenyl-tetrahydopyridine (MPTP) がパーキンソン病を引き起こすことが分かった。MPTPは、グリア細胞のミトコンドリア外膜にあるMAO-Bにより酸化されMPP+となりDA transporterにより、ドーパミン神経に特異的に取り込まれて、ラジカルとして作用し、ミトコンドリア呼吸鎖阻害、膜電位消失、各種酵素の活性化などにより、ドーパミンニューロンの変性を引き起こす。
pethidine (meperidine):グリア細胞ミトコンドリア外膜のMAO-Bで酸化
4、治療薬
DAの補充をするか、相対的に強くなったAch作用を抑える。日本神経学会のガイドラインによると、未治療のパーキンソン病の薬物治療は早期からドパミンアゴニスト、またはレボドパによる治療を開始する。
分類 | 作用別 | 薬物 | 解説 |
|---|---|---|---|
ドパミン作動薬 | 生合成促進 | レボドパ(levodopa、L-ドパ) | DAの前駆体で、dopa decarboxylaseによりDAとなる。 |
レボドパ +カルビドパ(carbidopa) レボドパ +ベンゼラジド(benserazide) | カルビドパとベンゼラジドは、ドパ脱炭酸酵素(dopa decarboxylase)を阻害するために、末梢でのレボドパの利用を減少させる。またBBBを通らない。従って、これらの薬物との併用により、高濃度のレボドパが中枢に移行する。これらの配合剤はwearing off現象の著明な患者に有効性を示している。 | ||
レボドパ + ゾニサミド(zonisamide) | ゾニサミドは抗てんかん薬で、DAの合成促進やMAO阻害により、レボドパの作用を増強し、wearing off 現象を改善する。 | ||
遊離促進 | アマンタジン(amantadine) | DAを遊離させる。NMDA受容体阻害作用あり。振戦の初期には有効。 | |
受容体刺激 | プラミペキソール(pramipexole)、 | 非麦角(non-ergotamine)系で、DA受容体を直接刺激する。ドパミン作動性神経に保護的に作用し、病態の進行を抑制。 突発的睡眠や傾眠がある。レストレスレッグズ(むずむず脚)症候群にも用いられる。 | |
| ブロモクリプチン(bromocriptine)、ペルゴリド(pergolide)、カベルゴリン(cabergoline) | 麦角(エルゴタミン、ergotamine)誘導体である。DA受容体を直接刺激する。ペルゴリドとカベルゴリンは心弁膜障害と心肺後腹膜繊維症の副作用が報告されており、第一選択薬としない。非麦角系の治療効果が不十分あるいは忍容性に問題がある患者にのみ投与する。 | ||
MAO阻害 | セレギリン(selegiline)、ラサギリン(rasagiline) | モノアミン酸化酵素(MAO-B)を選択的に阻害する。レボドパで効果不十分な時に用いる。固縮や無動の改善がある。三環性抗うつ薬との併用は禁忌。 | |
COMT阻害 | エンタカポン(entacapone) | カテコール-O-メチルトランスフェラーゼ(COMT)を阻害することにより、レボドパの半減期を延長する。レボドパ・カルビドパと併用すると、効果発現時間が長くなり、wearing-off現象を改善する。 | |
抗コリン薬 | ムスカリン受容体阻害 | トリヘキシフェニジル(trihexyphenidyl) | 末梢作用が弱い。振戦に有効。 |
ビペリデン(biperiden) | 上記に同じ。 | ||
ノルアドレナリン作動薬 | 合成促進 | ドロキシドパ(droxidopa) | パーキンソン病ではnoradrenalineの欠乏もある。ドロキシドパは脳内でnoradrenalineに変換される。レボドパの効果が不十分なすくみ足に有効。血圧上昇作用がある |
アデノシン受容体阻害薬 | A2A受容体阻害 | イストラデフィリン(istradefylline) | パーキンソン病では、図の3)の経路が活性化され、運動抑制が生じる。アデノシンA2A受容体は3)の経路の細胞に特異的に発現しており、GABAニューロンを活性化している。この受容体を阻害することによりパーキンソン病の運動抑制症状を改善させる。 |
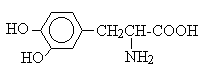
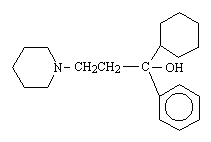
レボドパ(levodopa)
トリヘキシフェニジル(trihexyphenidyl)
a.レボドパ(levodopa、L-Dopa)
ドパミン(dopamine)は、BBBを通過できないので、前駆体でDOPAを用いる。 DOPAはdopa decarboxylaseの作用でDAになる。dopa decarboxylase阻害薬のカルビドパと併用することにより、レボドパの使用量を減らすことができる。
経口投与で、DOPAの10-20%が血中に入り、脳内へは1%が入る。末梢でもdopa decarboxylaseによりDAができるので、低血圧、頻脈、不整脈が生じる。5年間の治療で、半数は効かなくなる。
up and down:症状の改善と増悪が日内変動する。wearing off (end-of-dose akinesia):効果持続時間が短縮し、薬物濃度の変動とともに症状が、変動する現象で、次の薬剤を服用する前に効果の消退を自覚する。on and off:スイッチを入れたり切ったりするように急激に症状が変動する現象で、wearing offが予測可能であるのに対して、on-offは予測不可能であることが特徴である。
副作用
1) 悪心、嘔吐、食欲不振:嘔吐中枢の刺激による。
2) 起立性低血圧
3) 精神症状として、焦燥感、抑鬱、錯乱、幻覚がでる。
4) 異常不随運動
禁忌:非選択的MAO阻害薬との併用は禁忌。VB6と併用しない(dopa decarboxylaseを活性化する)。
b.ドパミンアゴニスト(dopamine agonists)
第二世代のドパミンアゴニスト(プラミペキソールなど)が開発され、L-Dopaに比して効果は弱いが、持続時間が長く安定している。これを使用することにより、L-dopaの運動合併症の発症を遅らせることができる。しかし、最近、ペルゴリドとカベルゴリンには心弁膜逆流障害と心肺後腹膜線維症の副作用があることが報告され、第1選択薬から外された。ドパミンアゴニストの効果が不十分になれば、L-Dopaを追加する。副作用として、突発的睡眠、妄想、せん妄などがある。
c.トリヘキシフェニジル
末梢作用の弱い中枢性抗コリン薬である。振戦に効くが、筋緊張や運動減少には効かない。副作用として、中枢作用では:錯乱、妄想、幻覚、せん妄など。末梢作用では:口渇、散瞳、悪心、動悸、排尿困難
話題
パーキンソン病におけるレビー小体(Lewy body)について
α-シヌクレインは、Torpedo(電気なまず)の発電器官を支配するコリン作動性神経のシナプス小胞から単離されたもので、核にも分布しているので、シヌクレインと命名された(1988)。1993年にアルツハイマー(Alzheimer)病のアミロイド(amyloid)斑から単離されたNACと同じものであった。α-シヌクレインは、レビー小体にユビキチン(ubiquitin)と共に多く含まれている。1997年に、遺伝性パーキンソン病の原因遺伝子がα-シヌクレインであり、点変異がA53Tにあることが明らかにされた。さらに、α-シヌクレインをマウス脳に過剰発現させると、黒質や皮質でレビー小体の蓄積が見られ、運動障害も生じた(2000)。
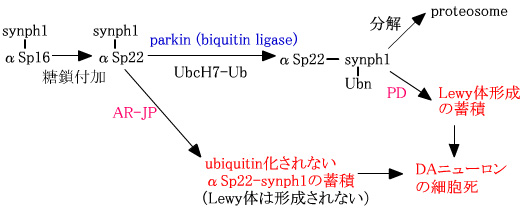
α-シヌクレイン(αSp16)は、synphilin-1(synph1)と強く結合しており、糖鎖付加を受けαSp22-synph1となる。parkinは、synph1をubiquitin化し、αSp16-synph1-Ubnとなり、proteosomeにより分解される。パーキンソン病(PD)では、α-シヌクレインに異常があるためにubiquitin化されたαSp22-synph1が分解されずに蓄積し、レビー小体を形成する。 |
α-シヌクレイン (αsyn)の細胞毒のメカニズムを調べた。αsynは小胞体(ER)からGolgiへの蛋白輸送を阻害することが分かった。このステップで、αsynの細胞毒性と関連している蛋白としてRab GTPaseを同定した。Rab GTPaseを、αsynを発現させたニューロンに導入すると、細胞死が抑制された。以上より、αsynとER-Golgiの結合による細胞障害作用をRab GTPaseが抑制することが示された。(Cooper, A.A. et al., Science 313, 324, 2006)
関連サイトの紹介
1、日本メジフィジックス 一般の方向け情報 「パーキンソン病の診断と治療って?」
2、兵庫県難病相談センター パーキンソン病
3、難病情報センター パーキンソン病(指定難病6)
(三木、久野)