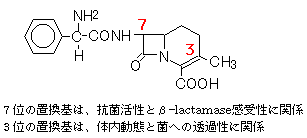
抗感染薬(Antiinfective drugs)(1)抗細菌薬(Antibacterial agents)
1899年、P. Ehrlichは、殺菌作用をもつ化学物質は、微生物と親和性を持ち、かつ固有の作用を示す必要があると考えた。つまり、抗生物質は、結合グループ(haptophore)と活性グループ(toxophore)を持つ必要がある。この考えから、生体成分と親和性のある色素に注目した。1935年、G. Domagkが赤色prontosilの殺菌効果を発見し、直後にパスツール研究所のグループが活性本体としてスルホンアミド(サルファ剤、sulfomanide)を見出した。1929年、A. Flemingがペニシリン(penicillin)の記載をして以来、本格的な抗生物質の開発が始まった。細菌性肺炎の死亡率が30%あったものが、サルファ薬により10%になり、ペニシリンにより5%に減少した。
1、総論
1)抗菌スペクトル
ある抗細菌薬が、増殖阻止作用を示す微生物の範囲を抗菌スペクトルといい、最小発育阻止濃度(MIC)により決められる。疾患の原因細菌が分かれば、どのような抗細菌薬が有効かを、抗菌スペクトル表を見れば見当がつく。さらに、感受性検査により、どの抗細菌薬が最適かを選択できる。感染の原因となる細菌を同定して、その最近に対して選択性の高い抗菌薬を用いるのが、細菌感染症治療の原則である。広域スペクトルを持つ抗菌薬を漫然と使い続けると、腸内常在細菌叢の攪乱、耐性菌の誘導、日和見感染、菌交代症などがおこり易くなる。
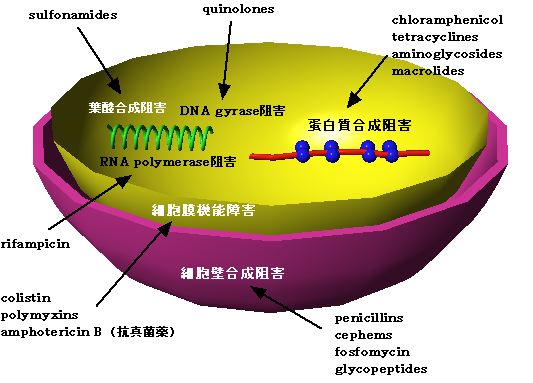
2)作用点および作用様式
抗細菌薬の作用点は、菌細胞特有の代謝系を阻害するので、動物細胞にはほとんど作用しない。 殺菌的作用:β‐ラクタム系(β-lactams)、アミノグリコシド系(aminogylcosides)、サルファ剤(sulfonamides) |
3)耐性菌形成機構
耐性機構 | 薬物 | 解説 |
|---|---|---|
不活性化酵素の誘導産生 |
|
|
| β‐ラクタム系(β-lactams) | βーラクタマーゼ(β-lactamase)による分解 |
| クロラムフェニコール(chloramphenicol) | CATase(-OH基をアセチル化)、アセチル化されると細胞膜の透過性が低下する(外膜変化)。 |
| アミノグリコシド系(aminogylcosides) | AAC(-NH2基をアセチル化)、APH(-OH基をリン酸化)、AAD(-OH基をアデニル化) |
細胞膜透過性の変化 |
|
|
| テトラサイクリン(tetracycline) | 細胞膜の透過性の変化により、テトラサイクリン(tetracycline)の流入を抑制する。 |
| ホスホマイシン(fosfomycin) | 能動輸送系の変化(排出ポンプ) |
| ほとんどすべての薬剤 | 緑膿菌は、菌体の周りに粘性に富んだ強力な保護膜(バイオフィルム)を形成することがあ。これにより抗菌薬が菌体に近づけなくなる。MDRP (多剤耐性緑膿菌、multidrug-resistant Pseudomonas aeruginosa) | |
作用点の変化 |
|
|
| マクロライド系(macrolides) | 50Sリボソームの変化 |
| アミノグリコシド系(aminogylcosides) | 30Sリボソームの変化 |
| ニューキノロン系(qinolones) | DNA gyrase の変化 |
| リファンピシン(rifampicin) | RNA polymeraseの変化 |
| サルファ剤(sulfonamides) | DHP synthaseの点変異 |
| メチシリン(methicillin) | 代替酵素の誘導産生(PBP-2') |
薬剤耐性のメカニズム(AMRリファレンスセンターのサイトより)
4)菌交代症(現象)
広域抗菌薬を用いたときに起こりやすい。それまで少数であった生き残り細菌(緑膿菌、耐性菌、真菌など)が増殖すること。良く知られているのは、ディフィシル菌(Clostridium difficile)による偽膜性大腸炎や出血性腸炎である。この菌はヒトの腸管の常在菌であるが、抗菌薬の投与により菌交代症を起こした場合、腸管内で菌が増殖して毒素を産生し、偽膜性大腸炎や出血性腸炎を引き起こすため、病院内感染として問題となっている。
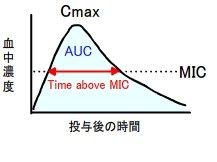
5)抗菌薬の効果に関与するパラメーター(PK-PD理論)
抗菌薬の効果を調べるために、薬物の体内動態(Pharmacokinetics)と抗菌活性(Pharmacodynamics)のパラメーターを知ることが大切である。前者のパラメータは、最高血中濃度(Cmax)と血中濃度時間曲線下面積(AUC)で、後者のパラメータは、最小発育阻止濃度(MIC)である。
実際には、抗菌薬の効果は、「Cmax/MIC」、「AUC/MIC」、「Time above MIC」で決まるので、各抗生物質の添付書類に記載されているパラメータを用いて計算をするとよい。
| 抗菌効果 | パラメータ | 理想的な投与法 | 抗菌薬 |
|---|---|---|---|
| 濃度依存性殺菌作用と長い持続効果 | Cmax/MIC AUC/MIC | 1回の投与量を増やす。 | キノロン系、 アミノ配糖体系 |
| 時間依存性殺菌作用と短い持続効果 | Time above MIC (T>MIC) | 投与回数を増やす。 ゆっくりと点滴する。 | ペニシリン系、セフェム系、モノバクタム系、カルバペネム系 |
| 時間依存性殺菌作用と長い持続効果 | 24-hour AUC/MIC | 1回の投与量を増やす。 | マクロライド系、テトラサイクリン系、バンコマイシン |
参考文献:Craig,WA, Clin. Infect. Dis., 26, 1-12, 1998、Nikkei Medical 2008.11, 61.
2、核酸合成を阻害する薬物
1)サルファ剤(sulfonamides)
抗生物質の出現まで広く使用されてきたが、最近では適用範囲は尿路感染症などに制限されている。耐性菌も高率に検出されている。カリニ肺炎にも用いられる。
分類 | 薬物 | 作用機作 | 副作用 |
|---|---|---|---|
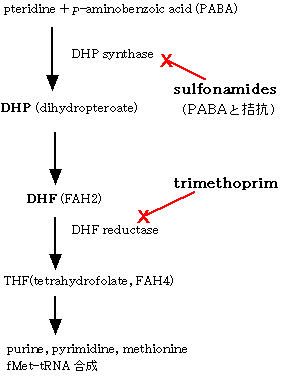
サルファ剤(sulfonamides) | スルファメトキサゾール(sulfamethoxazole) | ジヒドロプテロイン酸合成酵素(dihydropteroate synthase)の阻害により葉酸合成を阻害する。動物では葉酸を食餌から摂取するので、サルファ薬は作用しない。 | 血液障害 。過敏症。酸性尿下での析出による腎および尿路障害。新生児では、アルブミンが少ないので、高ビリルビン血症を引き起こす。皮膚粘膜眼症候群(Stevens-Johnson症候群)。 |
サルファ剤との併用薬(ST合剤) | トリメトプリム(trimethoprim) | ジヒドロ葉酸還元酵素(dihydrofolate reductase)を阻害する。サルファ薬との併用により相乗的に働く。 |
|
スルファメトキサゾール(sulfamethiazole)
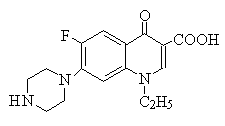
2)ニューキノロン系(quinolones)
1962年に合成されたオールドキノロン系のナリジクス酸(nalidixic acid)などは、緑膿菌以外のグラム陰性杆菌に有効であったが副作用が多かった。その後、ニューキノロンが合成され、抗菌力が強くなり、緑膿菌やグラム陽性菌にも有効となる。経口投与が可能。現在最も高頻度に使われる抗生物質の1つである。レジオネラ肺炎には第1選択。
薬物 | 作用機作 | 副作用 |
|---|---|---|
シプロフロキサシン(ciprofloxacin) | DNA gyrase 阻害によりDNA複製を阻害する。動物細胞でのtopoisomerase II にはほとんど作用しない。胆汁や前立腺にも高濃度で分布し、また尿中に高濃度排泄される。尿路感染症に最も有効である。シプロフロキサシン(CPFX )はグラム陰性桿菌と緑膿菌感染に使用される。レボフロキサシン(LVFX )は経口薬で唯一抗緑膿菌活性を持つ薬物である。シタフロキサシン(sitafloxacin、STFX)は呼吸器および尿路感染症に有効で、他のキノロン系薬の耐性菌にも働く。 | 胃腸障害、過敏症、精神神経症状など。薬物相互作用(QT延長を来す薬剤との併用、 経口血糖降下薬との併用、MgやFe剤やアルミニウム製剤との併用における吸収低下(キレート形成)、 NSAIDsとの併用(痙攣誘発のリスク))に注意が必要である。結核菌に効果があり、肺結核の診断を遅らせる可能性がある。 |
レスピラトリーキノロン:呼吸器組織(上気道も含む)への移行が良好で,ほとんどすべての呼吸器感染症起炎菌に対する抗菌力を有する,特に肺炎球菌への抗菌活性が強化されたニューキノロン系抗菌薬のこと。モキシフロキサシン(MFLX)は抗菌力や薬物動態において上記の薬物では最も優れている。特に、腎機能障害患者ではMFLXを選択すべきである。緑膿菌や嫌気性菌までを想定する場合はシタフロキサシン(STFX)を、高齢者など安全性を重視する際にはレボフロキサシン(LVFX)を選択することが推奨される。
norfloxacin
3、細菌細胞壁の合成を阻害する薬物
a) ペニシリン系(penicillins)
1) ペニシリンの作用機序
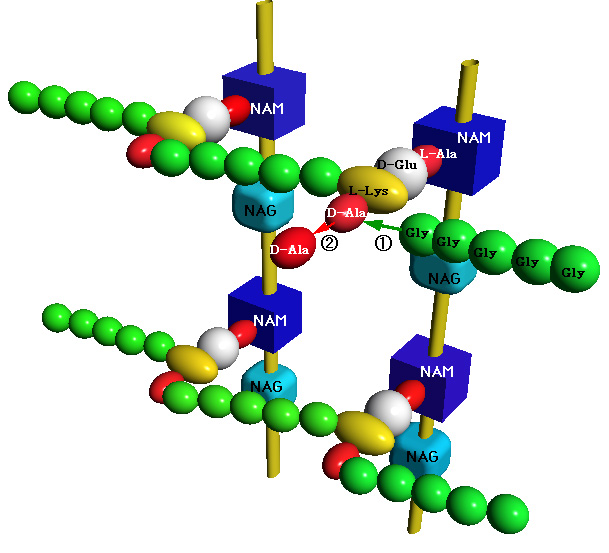
黄色ブドウ球菌(Staphylococcus aureus)の細胞壁は、N-acetylmuramic acid (NAM) とN-acetylglucosamine (NAG)の交互ポリマーが、ペプチド鎖(5ヶのglycine)で架橋された構造をしている。架橋を仲介する酵素が、transpeptidase(1の反応 )である。架橋の際に、末端のD-Alanineがはずれる。これを仲介する酵素がcarboxypeptidase(2の反応)である。penicillinは、この両酵素を阻害するが、前者の酵素阻害が、抗菌作用に重要である。NAMのペプチド末端のD-Ala-D-Alaの立体構造が、penicillinと類似しているので、penicillintranspeptidaseに結合し、不活性化(acyl化)する。これにより細胞壁の合成が阻害され、細菌内部の高浸透圧により細菌の破壊が起こる(殺菌的作用)。 |
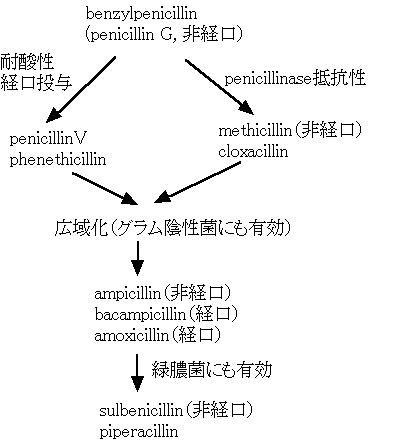
2) ペニシリン系の開発
上の図のように、開発が進むに従って抗菌スペクトルは広がったが、グラム陽性菌に対する抗菌力は弱まった。
ベンジルペニシリン(benzylpenicillin)
3)ペニシリン耐性菌
通常の耐性獲得は、βーラクタマーゼ(β-lactamase) によるペニシリンの分解による。MRSA(メチシリン耐性黄色ブドウ球菌)は、耐性黄色ブドウ球菌用ペニシリンとして開発された メチシリン(methicillin) に対して耐性を獲得した菌をいう。この菌は、抗黄色ブドウ球菌用ペニシリンだけでなく、抗緑膿菌用のペニシリンにも耐性を持つ。さらに、多くのセフェム系薬に対しても耐性を示す。耐性菌の持つ、メチシリン耐性遺伝子(mec A)は、ペニシリン結合蛋白質-2(PBP-2')を産生する。これは細胞壁合成の酵素の一種で、本来の細胞壁合成酵素の代替酵素である。
PBP-1A, PBP-1B | transpeptidase |
PBP-2 | methicillinに親和性あり。 |
PBP-2' | MRSAで誘導産生される。 |
PBP-3 | 隔壁形成 |
PBP-4 | carboxypeptidase |
4)β-ラクタマーゼ阻害剤配合剤
タゾバクタム(tazobactam)、スルバクタム(sulbactam)やクラブラン酸(clavulanic acid)などのβーラクタマーゼ(β-lactamase)阻害薬は、それ自身の抗菌作用は低いが、βラクタマーゼと不可逆的に結合し、その酵素活性を半永久的に不活化することで、β−ラクタム系抗菌薬の治療効果を高める。
タゾバクタム(tazobactam):ピペラシリン(piperacillin)=1:8の製剤は、誤嚥性肺炎や院内肺炎などの重症感染症に用いられている。MRSAと非結核性抗酸菌症(非定型抗酸菌症)には効かない。
スルタミシリン(sultamicillin)は、経口投与後速やかに吸収され、腸管のエステラーゼにより加水分解されてアンピシリン(ampicillin)とスルバクタム(sulbactam)とになり、それぞれ高い血中濃度を示す。アンピシリンとスルバクタムの合剤。βラクタマーゼ産生性耐性菌に有効。単独投与時より高い血中濃度が得られる。誤嚥性肺炎や院内肺炎などの重症感染症に用いられている。
5)副作用
過敏反応(発疹、血管浮腫、気管支痙攣、アナフィラキシーショックなど)は、0.7-1.0%に見られる。経口投与では過敏反応は少ない。伝染性単核球症患者の90%にアンピシリン投与後に発疹が出る。
b) セフェム系(cephems)
1) セファロスポリン類(cephalosporins)
β-lactam環を持ち、作用機序はペニシリンと同じである。cephalosporinaseで分解される。世代があがるとグラム陰性菌への抗菌力は強くなるが、陽性菌へは弱くなる。広い抗菌スペクトルを持ち、全抗生物質の50%以上使用されている。副作用は少ないが、ペニシリンと同じく、過敏反応を引き起こす。菌交代症に注意が必要である。
分類 | 薬物 | 特徴 |
|---|---|---|
第一世代 | セファロリジン(cephaloridine) | penicillinaseに安定、cephalosporinaseに不安定。黄色ブドウ球菌(MSSA)、連鎖球菌などのグラム陽性菌に効くが、肺炎球菌,腸球菌,リステリアには効かない。グラム陰性菌には使われない。セファロリジンとセファゾリンは静注で用いられる。セファレキシンは経口で用いられ、バイオアベイラビリティは高い。髄液には移行しない→髄膜炎には使えない。 |
第二世代 | セフォチアム(cefotiam) | cephalosporinaseに安定、グラム陰性菌に対する抗菌力が増強され、インフルエンザ菌、大腸菌などの陰性桿菌にも有効。静注あるいは筋注で用いられる。髄液には移行しない。 |
第三世代 | セフォタキシム(cefotaxime) | 高い安定性、抗菌力増強、緑膿菌やセラチアにも有効。逆にグラム陽性菌への抗菌力が弱くなる。肺炎+尿路感染をほぼカバーできる。髄液にも移行する。セフトリアキソンは、ほとんどの口内嫌気性菌をカバーするので、口腔衛生が保たれていれば、市中誤嚥性肺炎への使用が推奨される。 腸内細菌叢の急激な抑制に伴うビタミンKの欠乏により出血をおこすことがある。 この世代の経口剤は、バイオアベイラビリティが16~46%と低い。一方、腸での吸収改善のためにピボキシル化された薬物では、小児(特に乳幼児)において血中カルニチンの低下に伴う低血糖症状(意識レベル低下、痙攣等)がおこることがある(サイトへ)。 |
第四世代 | セフピロム(cefpirome) | 第一世代のグラム陽性菌への抗菌力と第三世代のグラム陰性菌への抗菌力を持ち、黄色ブドウ球菌や緑膿菌にも有効。髄液移行性もある。MRSA、腸球菌、嫌気性菌には効かない。 |
セファレキシン(cephalexin)
2) セファマイシン系(cephamycins)
セファマイシン系は基本骨格にメトキシ基を持つことによりβーラクタマーゼ(β-lactamase)に対して極めて安定である。大腸菌,プロテウス,クレブシエラなどに有効。嫌気性菌にもほぼ有効。セフブペラゾン(cefbuperazon)、セフメタゾール(cefmetazole)などがある。
c) カルバペネム系(carbapenems)
グラム陽性菌、緑膿菌などのグラム陰性菌、嫌気性菌になどに対して超広範囲スペクトルを持ち、ペニシリナーゼやセファロスポリナーゼにも安定である。近年、カルバペネマーゼを産生する耐性菌が出現しているので、長期間の使用による多剤耐性緑膿菌の出現に注意すべきである。天然型のイミペネム(imipenem)は腎尿細管のデヒドロペプチダーゼ-I(DHP-I) に分解され、腎毒性を示すので、イミペネムとDHP-I阻害薬のシラスタチン(cilastatin)との配合薬として用いる。メロペネム(meropenem)、ビアペネム(biapenem)はDHP-Iに安定で腎毒性や神経毒性を示さず、単独で用いることができる。経口剤としてテビペネムピボキシル(tebipenem-pivoxil)がある。カルバペネム系薬物は個々のスペクトルは大差がなく、使い分ける必要はないとされる。MRSAや腸球菌には効果がないが超広範囲スペクトルのために耐性菌が生じやすいとされている。実際、カルバペネム系の使用が多い病院では耐性菌の発生も多いという報告もあるので、最後の切り札としてとって置くといういう意見もある(サイトをみる)。
d)モノバクタム系(monobactams)
他のβ-ラクタム系抗生物質はラクタム環に別の環が結合しているのに対して、本化合物はラクタム環が単独で存在している。 β-lactamaseに対して安定。グラム陰性菌にのみ抗菌作用を発揮し、その効力は第三世代セフェム系よりも強い。そのために菌交代現象(偽膜性腸炎など)を起こしにくいとされる。アズトレオナム(aztreonam)、カルモナム(carumonam)などがある。
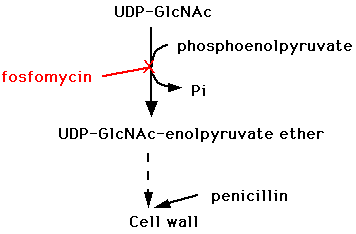
e) ホスホマイシン(fosfomycin)
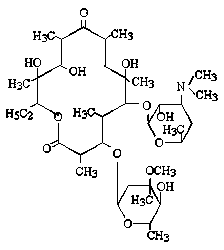
単純で、特異的(C-P結合をもつ)な構造を持つために、他の抗菌薬(抗生物質)と交差耐性を示さないとされている。。細胞壁合成の初期段階で、細胞壁を構成するペプチドグリカンの生合成に関わるpyruvate transferaseを阻害する。(他のペニシリン系、セフェム系などのβラクタム系抗菌薬は細胞壁合成の最終段階を阻害する。)比較的広い抗菌スペクトルを持ち、緑膿菌、プロテウス菌、セラチア菌、大腸菌、黄色ブドウ球菌などに活性を示す。
fosfomycin
f) グリコペプチド系(glycopeptides)
バンコマイシン(vancomycin)が代表的な薬物である。βラクタム剤とは作用機序が異なり、細胞壁合成酵素には結合せず、細胞壁を構成するペプチドグルカン前駆体に強く結合して細胞壁の合成を阻害し、細胞壁の合成を阻害する。高分子(MW1500)であるため、グラム陰性菌を通過できない。従ってグラム陽性菌にのみ有効である。MRSAに対する第一選択薬である。別の抗生物質で引き起こされる「偽膜性大腸炎」にも有効。偽膜性大腸炎は、抗生物質により腸内の善玉細菌が死滅し、生き残ったクロストリジウム・ディフィシルという細菌が異常に増殖することで発症する。vancomycinは、そのクロストリジウム・ディフィシルに対し強い抗菌力を発揮する。
菌の耐性化を極力回避し、有効かつ副作用を生じない投与量及び投与方法で必要最小限に止めるためには薬物血中濃度モニタリング(Therapeutic Drug Monitoring: TDM)が重要。TDMの2つの目的:1)菌を減少させるのに有効な濃度に達しているかを確認する(offensive TDM)2)副作用を招くような濃度で推移してないかを確認すること(defensive TDM)。
g) 環状リポペプチド系(cyclic lipopeptides)
ダプトマイシン(daptomycin)は、リポペプチド系の静注抗菌薬で、MRSA感染による皮膚軟部組識感染や敗血症、右心系感染性心内膜炎などの治療薬として開発された。Caイオン依存的にグラム陽性菌の細胞膜に結合し膜中に挿入され、オリゴマーを形成してイオン透過性ポアー を形成する。このポアーを通してKイオンが流出することにより、RNAやDNAや蛋白質の合成が阻害され、細胞融解を引き起こすことなく細胞死が起こる。ダプトマイシンは、グラム陽性菌に抗菌力があり、MRSAを含む黄色ブドウ球菌、β溶血性連鎖球菌、α連鎖球菌、バンコマイシン耐性腸球菌を含む腸球菌などに対して比較的強い抗菌力を持っています。またグラム陽性桿菌や一部のグラム陽性嫌気性菌に対しても抗菌力がある。グラム陰性菌に対しては抗菌力がない。副作用は少ないが、骨格筋障害などが報告されている。呼吸器感染には使えない。
4、蛋白質合成を阻害する薬物
細菌のリボソームは、70Sで、50Sと30Sからなり、動物のものとは異なる。
ストレプトマイシン(streptomycin)、テトラサイクリン(tetracycline)、クロラムフェニコール(chloramphenicol)、エリスロマイシン(erythromycin)、リンコマイシン(lincomycin)などが代表的なものある。
マイコプラズマ、緑膿菌、クラミジア、結核菌などペニシリンが効かない微生物に対しても有効なものがある。マイコプラズマ(細胞壁を持たない)は非定型性肺炎を起こす。クラミジアにはトラコーマクラミジアとオウム病クラミジアがあり、前者は性行為感染症(STD)、後者は呼吸器感染症の主要な起炎微生物。トラコーマクラミジアは、男性では特に非淋菌性尿道炎の起炎菌となる。女性では、子宮頸管炎の原因菌となる。新生児への垂直感染では、急性濾胞性結膜炎や肺炎を起こす。
1)アミノグリコシド系(aminoglycosides)
ストレプトマイシン(streptomycin)が代表薬である。1944年に、Selman A. Waksmanは、結核菌が土の中で急速に死滅することに着目し、土中微生物(Actinomyces)から、streptomycinを発見した。グラム陽性菌やグラム陰性菌にも有効で、広域スペクトルの抗生物質の第1号である。経口投与ではほとんど吸収されない。続いて、カナマイシン(kanamycin)、ネオマイシン(neomycin)、ゲンタマイシン(gentamicin) などが開発され、緑膿菌を含むグラム陰性桿菌に有効。嫌気性菌・腸球菌には効かない。聴器障害と腎毒性の副作用があるので、血中濃度測定(TDM)が必要。βラクタム系との併用で効果が増強される(シナジー効果)。
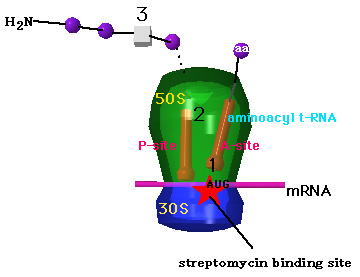
streptomycin
streptomycin は、30Sに結合し、30Sと50Sリボソームからなる複合体を固定するので、1)蛋白合成の開始を阻害、2)A位からP位へのtransloactionの阻害と、premature termination、3)誤ったアミノ酸の取り込み(立方体)を引き起こす。 |
副作用
代謝されずに腎臓で排泄されること、極性分子であるので組織移行性は悪いが内耳には移行するために、腎障害と第8脳神経障害(聴力および平衡障害)がでる。第8脳神経障害による耳毒性の多くは不可逆性であり、しかも高音域から始まるので日常会話では病初期には気づきにくい。神経筋遮断作用もある。
2)テトラサイクリン系(tetracyclines 、TC)
テトラサイクリン(tetracycline) が代表薬で、これほど広いスペクトルをもつものは他にないが、耐性菌は多い。現在では、グラム陽性球菌やグラム陰性桿菌の多くが耐性を示す。しかし、リケッチャ、マイコプラズマ、クラミジア、コレラ、ブルセラには第一選択薬である。非定型抗酸菌感染症にも有効。ミノサイクリン(minocycline)は、脂溶性が高く、腸管から吸収されやすく、菌交代症を生じにくい。
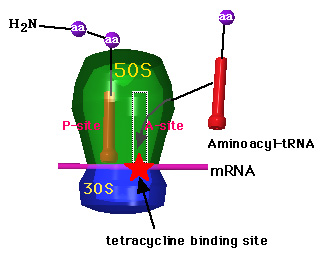
テトラサイクリン(tetracycline)
テトラサイクリン(tetracycline)は、リボソームの30Sに結合し、aminoacyl-tRNAのA siteへの結合を阻害する。 |
副作用
カルシウムと親和性があり、若年者の歯の着色と歯の破壊をおこす。菌交代症により、下痢や腸炎などの胃腸障害。新生児での頭蓋内圧の上昇。肝障害。
3)クロラムフェニコール(chloramphenicol、CP)
テトラサイクリン(tetracycline)と並ぶ広い抗菌スペクトルを示す。耐性菌も多く出ている。高頻度に再生不良性貧血を引き起こすので、限られた感染症に用いられている。すなわち、サルモネラ症(腸チフス、パラチフス)の第一選択薬。その他、リケッチヤ、クラミジアにのみ用いられる。
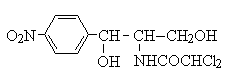
クロラムフェニコール(chloramphenicol)
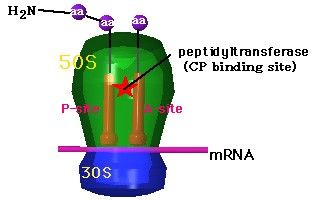
chloramphenicol は、リボソーム(50S)上でのP座のペプチジルtRNAから、A座のアミノアシルtRNAへのペプチド鎖移動を司るペプチジルトランスフェラーゼ(peptidyltransferase9 に結合し、新しいアミノ酸を利用できないようにすることで蛋白質合成を阻害する。 |
副作用
赤血球減少(服用者の約1/3にみられる)。再生不良性貧血は遺伝的素因によるもので25,000-40,000人に一人みられる。低用量でも発生するため注意が必要である。乳幼児の肝臓では、グルクロン酸抱合が未発達なので、多量のCP投与により、腹部膨満感に始まる嘔吐、下痢、皮膚蒼白、虚脱、呼吸停止等 のGray baby syndrome(灰白症候群)を生じる。
4) マクロライド系(macrolides)
エリスロマイシン(erythromycin、EM)が代表薬である。グラム陽性菌に有効で、ペニシリンの代用として用いられる。多くの耐性菌が出現している。マイコプラズマやクラミジアに有効である。肺への移行がよいので、マイコプラズマ肺炎や新生児クラミジア肺炎の第一選択薬である。50Sに結合し、ペプチドの延長阻害をする。非結核性抗酸菌症(非定型抗酸菌症)や百日咳に有効。
erythromycin
副作用
長期使用で、肝障害をひきおこす。
クラリスロマイシン(clarithromycin)
ニューマクロライド系と呼ばれ、抗菌力、酸抵抗性、組織への移行性が優れている。マイコプラズマ肺炎やレジオネラ感染に有効。ヘリコバクターピロリ(Helicobacter pylori)の除菌にも用いられる。次の3剤併用が用いられる。 プロトンポンプ阻害剤、AMPC (amoxicillin)、CAM (clarithromycin)。2次除菌としてclarithromycinの代わりにメトロニダゾール(metronidazole)(トリコモナスやアメーバ赤痢などの抗原虫薬)を使った3剤併用や、PPIの代わりにボノプラザンを使った3次除菌が新たに追加された。
アジスロマイシン(azithromycin)
15員環マクロライド系抗生物質で、ブドウ球菌、連鎖球菌、肺炎連鎖球菌、インフルエンザ菌などに有効。500mgを1日1回、3日間投与で、組織内有効濃度が7日間維持できる。azithromycinは、食細胞に取り込まれ運ばれるので肺炎などの感染組織で濃度が高くなる。インフルエンザ菌などのグラム陰性菌に対して抗菌力が強い。サルモネラ、赤痢、クラミジア感染にも有効。
5)リンコマイシン系(lincomycins)
クリンダマイシン(clindamycin)が代表。マクロライド系に近縁の抗生物質である。リボソーム50Sに作用し、ペプチド転移酵素反応の阻害作用により、蛋白質合成を阻害作する。主として、グラム陽性菌に有効である。嫌気性菌にも有効である(嫌気性菌であっても、クロストリジウム・ディフィシル(Clostridium difficile)には効かない)。嫌気性菌の存在を強く疑う場合(口腔内が極めて汚い場合、膿性痰が著明など)の誤嚥性肺炎などに用いる。副作用として、重篤な下痢(偽膜性大腸炎)を引き起こす。
5、抗結核薬(Antimycobacteria drugs)
世界では、総人口の約3分の1(20億人)が結核に感染しており、毎年800万人が新たに発病し、200万人が命を落としている。その多くはアジア地域をはじめとする開発途上国であるが、日本でも主要な感染症の1つである。
日本における結核の現状は、全国に広くまん延していた時代から、高齢者等、都市部を中心に患者が集中する時代に変化している。しかし、依然として主要な感染症であることには変わりなく、先進国のトップグループの罹患率とは差があり、世界の中では中まん延国とされている。2016年の1年間に新たに結核患者として登録された人は17,625人、死亡する人は1,889人であった。また、最近はベトナムなどの開発途上国からの若年労働者の流入に伴い、外国人居住者の結核感染者が増加している。
現在の高齢者は、若い頃に結核流行時を経験していて、既に結核に感染している人が多く、体力・抵抗力が低下した時に、眠っていた菌が目を覚まし発病しやすくなる。反対に、若い世代の多くは未感染のため、菌を吸い込むと感染しやすく比較的早い時期に発病する危険がある。
さらに、HlV/AIDSは日本で増加の一途をたどっており、1年間の新規のHIV感染者数とAIDS患者数の合計は、すでに1千件を超えている(2017年では1389件)。HIV感染者では免疫が低下しているため、HIV感染の増加が結核のまん延を加速させる可能性がある。さらに、結核とAIDSの合併は重症がつ難治であるため、今後問題となる危険をはらんでいる。タイやインドネシアなどの国では既に社会問題となっている。
結核菌は活動性結核患者が咳やくしゃみをした時に飛び散り、それを周りの人が直接吸い込むことによって感染する。結核の初期症状は、風邪とよく似ている。ツベルクリン反応、インターフェロン-γ遊離試験、喀痰の塗抹培養、PCRなどによる早期発見が適切な治療につながり、また集団感染などの事例をなくすことにもつながる。(公益財団法人結核予防会のHPより改変して転載)
a)抗生物質
1) ストレプトマイシン(streptomycin 、SM)
2) カナマイシン(kanamycin、KM)
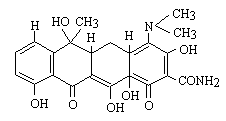
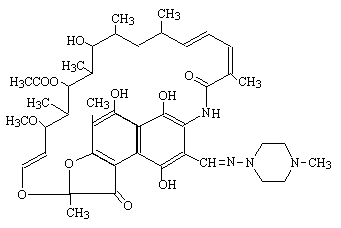
3) リファンピシン(rifampicin、RFP)
DNA dependent RNA polymerase 活性を阻害する。副作用として、血小板減少がある。
rifampicin
b)合成化合物
1)パラアミノサリチル酸(p-aminosalicylic acid 、PAS)
PABAの類似構造で、葉酸の合成を阻害する。現在ではほとんど使用されない。
2)イソニアジド(isoniazid、INH、イソニコチン酸ヒドラジド)
結核菌に特有のミコール酸の合成阻害。休止菌には作用しない。殺菌的作用。
副作用として、末梢神経炎がある。ピリドキシン(pyridoxine、vitamine B6)と拮抗するためにおこる。神経障害を予防するために、ピリドキシンがイソニアジドと共に投与されることがある。
3)エタンブトール(ethambutol、EB)
ミコール酸の合成と結核菌細胞壁へのミコール酸の取り込みを阻害する。結核菌に対し特異的に作用し、他の抗結核薬と交叉耐性を示さない。イソニアジドまたはストレプトマイシンと併用することにより耐性菌の出現は低減され、それらの耐性菌にも有効。副作用として、視神経障害と重篤な肝障害がある。
4)ピラジナミド(pyrazinamide、PZA)
主に静菌的に作用するが、活発に分裂する結核菌に対しては殺菌的に作用する。 治療初期に有効であり、リファンピシン、イソニアジドとの併用により再発率が低下するとされている。治療初期 2 カ月間に PZA を加えた初期強化療法は,薬剤耐性発現の防止,早期の菌陰性化,治療期間の短縮化など,患者に多くの利益がもたらされるとされる。1996 年に結核医療の基準が改定され,標準化学療法の一つとなり、その使用が勧められている。PZA を含む 4 剤併用療法が広く普及し、PZA含む治療方式が標準化学療法の一つとなった。
c)結核の標準治療
薬剤感受性が確認できない初期治療では、イソニアジド(INH)とリファンピシン(RFP)に、エタンブトール(EB)またはストレプトマイシン(SM)を加えた3剤以上の併用が必要。さらにピラジナミド(PZA)を加えた4剤処方により、薬剤耐性発現の危険性低下、治療期間の短縮が期待できる。ただし、肝障害患者および妊婦では使用を避け、80歳以上の高齢者への使用は慎重に。標準治療薬には、リファブチン(RBT)もあるが、使用可能な薬剤数が不足する場合に十分に検討したうえで使用(メディカルオンラインより)。わが国の結核患者は高齢者が多いこと、また高齢者は死亡者が多いことなどから、PZA が使用されるようになっても治療成績は悪く、WHO の目標とする治療成功率 85% に達していない。
6、代表的な耐性菌とその治療薬
抗菌薬(抗生物質)の不適切な使用が薬剤耐性(Antimicrobial Resistant: AMR)の問題を生んでいる。ヒトは多くの微生物と共存しているが、抗菌薬を使用することで、これらの常在菌から耐性菌が選ばれ、将来薬剤耐性菌による感染症を発症する危険性が生じる。抗菌薬は細菌感染には効果があるが、ウイルスには効果がない。しかし、ウイルスの上気道感染である風邪症候群に抗生物質が効くと信じている患者はいまだ多い。医師も、ウイルス感染症と診断しても、細菌による二次感染するのを予防する目的で、抗菌薬を処方することが少なくない。しかし、このような二次感染を予防するエビデンスはなく、体内で耐性菌を増やす原因を作るだけである。また、抗菌薬を使用する時は、原因菌を同定し、菌に有効だとされる抗菌スペクトルの狭い薬物を使うのが原則であるが、原因菌を同定せずに第三世代セファム系などの薬物が使われることも耐性菌を生じる原因である。現状のような抗菌薬の乱用が続けば、抗菌薬の開発が耐性菌の出現に追いつかないため、2050年には世界での耐性菌感染症による死亡者ががんによる死亡者を超して1000万人にも達するという試算も出ている。
1)グラム陽性球菌
| 耐性菌 | 説明 | 治療薬 |
|---|---|---|
| MRSA(メチシリン耐性黄色ブドウ球菌、Methicillin-Resistant Staphylococcus aureus) | β-ラクタム剤が結合できないペプチドグリカン合成酵素(PBP2')を作ることでβ-ラクタム剤の作用を回避する。PBP2’の遺伝子mecAを含む遺伝子領域が、他の菌種から黄色ブドウ球菌に持ち込まれ、染色体上に挿入されたことによる。 多剤耐性:ほとんどのMRSAが、ペニシリンだけでなく、セフェム系、カルバペネム系、ニューキノロン系、アミノグリコシド系薬剤など多剤に耐性となっている。 | バンコマイシン(vancomycin 、VCM, グリコペプチド系、第一選択薬、要TDM)、ダプトマイシン(daptomycin、DAP、環状リポペプチド系、呼吸器感染には使えない)、テイコプラニン(teicoplanin 、TEIC, ペプチド系、要TDM)、リネゾリド(linezolid 、LZD, オキサゾリジノン系、タンパク質合成阻害、VRE・VRSAの治療薬 → MRSAにも使用拡大、内服薬あり(吸収率99%))、アルベカシン(arbekacin、ABK, アミノグリコシド系、副作用:腎障害、聴力障害、組織移行不良) |
| VRE(バンコマイシン耐性腸球菌、Vancomycin Resistant Enterococci) | ほとんどの薬剤に耐性であり、感染症が起きた場合には治療が困難。ハイリスク患者には伝播が起こりやすいため注意が必要。 | リネゾリド(linezolid 、LZD, オキサゾリジノン系、タンパク質合成阻害)他に安定した効果が期待できる抗菌薬はない。既にリネゾリドに耐性化した菌も報告されている。感染予防が極めて重要。 |
2)グラム陰性桿菌
| 耐性菌 | 説明 | 治療薬 |
|---|---|---|
| ESBL(extended-spectrum β-lactamase)産生菌 | ESBLとは基質特異性拡張型βラクタマーゼ(extended-spectrum β-lactamase)の略称。Klebsiella pneumoniae や Escherichia coli などが保有する伝達性プラスミド上にコードされているβラクタマーゼ産生遺伝子が、突然変異により分解可能な薬剤の種類を広げ、ペニシリンだけではなく、第三世代の広域セフェム系まで分解するβラクタマーゼを産生するようになったもの。このESBLは、クラブラン酸などのβラクタマーゼ阻害薬によりその活性が阻害される。 | カルバペネム系抗菌薬(イミペネム(imipenem)、メロペネム(meropenem)、ビアペネム(biapenem))の有効性は確立されている。重症感染症に対してはカルバペネム系抗菌薬が第一選択薬となる。軽度~中等度の尿路感染症や胆道感染症には、β-ラクタマーゼ阻害剤配合薬、セファマイシン系等が使用される場合がある。 |
| MDRP (多剤耐性緑膿菌、multidrug-resistant Pseudomonas aeruginosa) | カルバペネム系、ニューキノロン系、アミノグリコシド系の3系統に耐性をもったものを多剤耐性緑膿菌(MDRP)と呼ぶ。耐性メカニズムは、① DNA ジャイレースなどの標的蛋白の変異(フルオロキノロン耐性)、② D2 ポリンの減少など細菌外膜の変化(イミペネム耐性)、③ 薬剤能動排出ポンプの機能亢進(フルオロキノロン耐性、消毒薬抵抗性など)、④ AmpC 型β‐ラクタマーゼなど分解酵素の過剰産生(広域セファロスポリン耐性)、⑤ バイオフィルムの産生の増加など、複数あるが、プラスミド性の耐性遺伝子伝播も重要な役割。→接触感染予防が重要となる。 | 現存するすべての抗緑膿菌抗菌薬に対して耐性を持つ。治療としては、①コリスチン(日本未認可薬剤)あるいは、②併用抗菌薬療法?・・・単剤では治療困難な抗緑膿菌作用のある薬剤を2剤併用する。ぐらいしかない。感染予防が極めて重要。多剤耐性緑膿菌感染症についての感染症情報センターの医療者向け情報はこちら。 |
7.抗菌薬の適正使用
適正な抗菌薬を使用することは、効果的な治療に直結するだけでなく、耐性菌を増やさないことに結びつく。このため、各医療機関では、抗菌薬用を適正に使用するためのマニュアルを作成していることが多い。以下に2つの医療機関のマニュアルの一部を紹介する。
1)抗菌薬選択の基本
(京都私立病院協会 感染症対策委員会編 2016年3月版より改変・抜粋して転載)
(1)感染症の存在の確認
下記の項目を総合的に評価して感染症であるか判断する
① 身体所見 ② 炎症所見 ③ 画像所見 ④ 病原体の検出 ⑤ 鑑別すべき疾患
(悪性腫瘍、アレルギー疾患、膠原病、血液疾患、中枢性疾患、内分泌疾患など)
(2)原因菌の確認
原因菌を同定するために下記の項目に重点を置く
① 検体の細菌検査は少なくとも一回以上は検査する
② できるだけ常在菌の混入を避ける工夫
③ 2セット以上の血液培養は原因菌検索に有用
④ 血中抗体価測定、迅速診断法も有用
(3)原因菌の薬剤感受性
薬剤感受性試験を行う
適正な抗菌薬の指針となる
(4)抗菌薬の臓器移行性
感染臓器と薬剤の臓器移行性を考慮する
| 臓器 | 移行性が高い抗菌薬 |
|---|---|
| 肺 | マクロライド系薬 |
| 肝・胆汁 | マクロライド系薬 ニューキノロン系薬 テトラサイクリン系薬 リンコマイシン系薬 ペニシリン系薬(ピペラシリン) セフェム系薬(セフォペラゾン、セフブペラゾン、セフピラミド、セフトリアキソン) |
| 腎・尿路 | ペニシリン系薬、セフェム系薬、モノバクタム系薬、カルバペネム系薬 アミノグリコシド系薬 ニューキノロン系薬 グリコペプチド系薬 |
| 髄液 | クロラムフェニコール、ペニシリン系薬、カルバペネム系薬 セフェム系薬(セフトリアキソン、セフォタキシム、セフタジジム、ラタモキセフ) ニューキノロン系薬 |
*移行性は投与量、炎症の程度によって異なる
*ダプトマイシンは肺サーファクタントと結合する性質があるため、肺炎に対して有効性を期待できない
(5)抗菌薬の投与計画
① 投与経路
下記の表より投与経路を考慮する
| 投与経路 | 適応 | 留意点 |
|---|---|---|
| 経口 | 1.感染症の程度:軽症、中等症 2.基礎疾患のない患者 3.外来通院の患者 4.バイオアベイラビリティの高い薬剤を選択する場合(バクトラミン、ザイボックス、ミノマイシンなど) | ・簡便で使用しやすいが、服薬の確認が取れない ・服薬量に限界がある ・内服不能の患者への投与不可 |
| 注射 | 1.感染症の程度:中等症、重症 2.基礎疾患のある患者 3.入院患者 | ・確実に血中濃度を上げることができる ・ルートの確保が困難な患者、熱傷患者などでは投与しにくい |
| 局所 | 1.限局した感染症 2.抗菌薬の移行が低い局所の感染症 | ・耐性菌の出現に注意する |
② 抗菌薬の特性
下記の表より抗菌薬の特性を考慮する
| 殺菌性抗菌薬 | 静菌性抗菌薬 |
|---|---|
時間依存性抗菌薬 濃度依存性抗菌薬 | テトラサイクリン系薬 マクロライド系薬 クロラムフェニコール リンコマイシン クリンダマイシン |
③ 薬物動態学の特性(PK/PD)
PK/PD理論より投与量、投与時間などを考慮する
(6)抗菌薬の安全性
抗菌薬のデメリットを理解する
① 抗菌薬の副作用
② 薬剤に対するアレルギーの確認
③ ショックなどに対する安全対策
(7)宿主の状態
宿主側の条件を考慮する
① 小児、新生児
② 妊産婦
③ 高齢者
④ 肝障害
⑤ 腎障害
⑥ 副腎皮質ステロイド投与例
⑦ 抗がん薬投与例
⑧ 人工呼吸器装着例
⑨ 好中球減少症
⑩ 免疫不全例など
(8)耐性菌出現の防止
長期間の同一抗菌薬の投与は避ける
2)抗菌薬を適正に使うために
(鹿児島大学病院 感染症対策マニュアルより改変・抜粋して転載)
(1) 抗菌化学療法の基本的事項
① 必要と判断した場合のみ、抗菌薬を選択して投与法、投与量、投与期間を決める。
② 感染巣(臓器)と具体的病原菌を必ず想定する。
③ 抗菌薬の併用はエビデンスに基づいた適応例のみに限定する。
④ 抗菌薬以外の併用薬との相互作用にも十分に注意する。
⑤ 目的の不明確な抗菌薬の長期投与を避ける。
⑥ 周術期の予防的投与には手術の清潔度と部位により投与時期と抗菌薬の選択をする。
(2)投与方法
① 濃度依存的に作用するもの(フルオロキノロン系、アミノグリコシド系など)
濃度依存的に作用する抗菌薬は最高血中濃度に依存して効果を示す。さらに、PAE (post antibiotic effect:持続性)作用を持つことが知られている。したがって、1日量が同じであれば、1日2-3回に分割して投与するより、1回で投与した方が有効である。
② 時間依存的に作用するもの(β-ラクタム系;ペニシリン系、セフェム系など)
時間依存的に作用する抗菌薬はMIC(最小発育阻止濃度)以上の濃度で、菌と接触する時間が長ければ長いほど、有効である。したがって、1日2回よりも、1日3-4 回投与の方が有効である。
(3)治療効果の判定
① 抗菌薬投与開始後は原則として3日目前後にその治療効果の判定を行う。判定には細菌培養検査結果のみならず、患者の全身状態や感染臓器の状態を観察する。また、発熱、CRP、WBC、赤沈の改善、胸腹部画像検査所見の推移などを治療の有効性の判断に用いる。
② 抗菌薬を開始しても解熱しない場合はウイルス感染、他の発熱疾患や膿瘍の可能性を考えるとともに、細菌感染であっても不適切な抗菌薬、投与方法、投与量、投与間隔となっていないか検討する。
③ 抗菌薬開始後、解熱したのちに再度の発熱が認められた場合は薬剤熱や静脈炎、二次感染なども考える。
(4)抗菌薬の排泄経路
ほとんどの薬剤は腎排泄と肝・胆道排泄に分けられ、腎排泄の薬剤は腎機能低下時に、肝・胆道排泄の薬剤は肝機能低下時に減量など投与量の変更を考慮する必要がある。
| 主として腎排泄(腎機能低下時投与量変更) | 腎・胆道両方(極度の腎機能低下時のみ投与量変更) | 主として肝・胆道排泄(基本的には腎機能低下時投与量変更不要) |
|---|---|---|
ペニシリン系 | セフトリアキソン | セフォペラゾン |
腎排泄型薬剤の腎機能障害時の抗菌化学療法
初回投与量は腎機能正常者と腎機能障害者において、同様でなければならない。なぜなら、初回投与の目的は、人体という一定の容積の容器に一定量の治療薬を入れて、一定の濃度を作ることである。腎機能低下時はこの容器からの排泄が遅くなっているだけで、一定の容積に一定の濃度を作る作業は腎機能正常者、腎機能障害者において同じである。したがって、腎機能障害の有無にかかわらず、初回投与は通常量を投与し、維持量については腎機能に合わせて調節する。
維持量はクレアチニンクリアランスに従い決定する。ただし、筋肉量が少ない患者では、腎機能が低下しても血清クレアチニンが上昇せず、見かけ上、腎機能正常と評価してしまい、過剰投与になる可能性がある。このようなときは、尿量、BUN、シスタチンCなどをチェックし、投与量を決定する。逆に、多尿の場合は通常量では過小投与になることがあるので、患者状態を注意深くモニターしながら投与する。
肝・胆道排泄型薬剤の肝機能障害時の抗菌化学療法
明らかな肝硬変、凝固異常が出現するほどの肝機能障害をもつ患者では、減量など投与量の調節を考慮すべきである。しかし、肝機能障害の程度による抗菌薬の調整方法に関するエビデンスは少なく、また、肝予備能は個人差が大きいため、一概に投与量を決めることはできない。効果と副作用を評価しながら使用すべきである。
(5)抗菌薬の移行性
試験管の中でいかに優れた抗菌活性を示しても、実際に感染を起こしている組織に移行・浸透しなければ意味がない。特に、中枢神経系や前立腺などは抗菌薬によっては移行しないものがあるので、移行のよいものを知っておく必要がある。
8、Flemingのペニシリン発見の論文(1929)
On the antibacterial action of cultures of a penicillium, with special reference to their use in the isolation of B. Influenzae. Alexander Fleming, Br. J. Exper. Path., 5, 226-236, 1929.
SUMMARY
1. A certain type of penicillium produces in culture a powerful antibacterial substance. The antibacterial power of the culture reaches its maximum in about 7 days at 20℃ and after 10 days diminishes until it has almost disappeared in 4 weeks
2. The best medium found for the production of the antibacterial substance has been ordinary nutrient broth.
3. The active agent is readily filterable and the name "penicillin" has been given to filtrates of broth cultures of the mould.
4. Penicillin loses most of its power after 10 to 14 days at room temperature but can be preserved longer by eutralization.
5. The active agent is not destroyed by boiling for a few minutes but in alkaline solution boiling for 1 hour markedly reduces the power. Autoclaving for 20 minutes at 115 ℃ practically destroys it. It is soluble in alcohol but insoluble in ether or chloroform.
6. The actions very marked on the pyogenic cocci and the diphtheria group of bacilli. Many bacteria are quite insensitive, e.g. the coli-typhoid group, the influenza-bacillus group, and the enterococcus.
7. Penicillin is non-toxic to animals in enormous doses and is non-irritant. It does not interfere with leucocytic function to a greater degree than does ordinary broth.
8. It is suggested that it may be an efficient antiseptic for application to, or injection into, areas infected with penicillin-sensitive microbes.
9. The use of penicillin on culture plates renders obvious many bacterial inhibitions which are not very evident in ordinary cultures.
10. Its value as an aid to the isolation of B. influenzae has been demonstrated.
話題
β-lactam系の抗生物質は、これまで中枢神経系に無害といわれてきたが、グルタミン酸トランスポータGLT1の発現を増加させることが報告された。その結果としてグルタミン酸による神経毒を抑制することが分かった。ALSモデル動物に、ceftriaxoneを投与すると細胞死を遅延させた。(J.D.Rothstein et al, Nature, 433, 73, 2005、論文をみる)
合併症のない虫垂炎患者では、抗生物質治療が虫垂切除と同程度に優れていることが示された。抗生物質による治療は、1889年以来いわゆる“ゴールドスタンダード”であった外科手術の安全な代替法であるという。ノッティンガム大学のDileep Lobo氏は、「合併症のない急性虫垂炎と診断された時点で抗生物質の投与を開始し、再評価を行えば、ほとんどの虫垂切除術を行う必要がなくなり、罹病率が低下する。また、患者の入院期間も短縮される可能性がある。穿孔や腹膜炎の徴候が明らかな患者では、早期の虫垂切除術がやはりゴールドスタンダードである」と述べている。Lobo氏らは、計900例の虫垂炎患者を外科手術または抗生物質に無作為に割り付けた4件の研究のメタ分析を実施した。その結果、抗生物質治療群では63%が1年後にそれ以上の治療を必要とせず、外科手術に比べて合併症が31%少なかった。400例以上の抗生物質治療群の68例に再発症状が認められた。抗生物質投与群と外科手術群において、入院期間または合併症のある虫垂炎リスクに実際の差は認められなかった。(K.K. Varadhan et al, BMJ 2012; 344 doi: https://doi.org/10.1136/bmj.e2156、論文をみる )
関連サイトの紹介
1、東京医科大学病院感染制御部による「プライマリーケアのためのワンポイントレクチャー 感染症① 感染症② 感染症③ 多剤耐性菌の耐性機序と治療薬
2、国立感染症研究所 感染情報センター 薬剤耐性菌感染症
3、抗菌薬インターネットブック
4、薬剤耐性について知っていますか?
(久野)

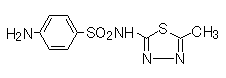
.gif?version=1&modificationDate=1548938291871&cacheVersion=1&api=v2)